病例介绍
患者,女性,62岁。2017年4月于当地医院行右拇指远端指骨切除术,术后病理示恶性黑色素瘤,术后未予特殊诊治。2018年6月底出现咳嗽、咳白痰伴气短,2018年7月16日就诊于外院,行胸部X线片示右侧胸腔积液。患者为求进一步诊治就诊于我科。
2018年7月10日行胸部CT示双侧胸廓对称,纵隔居中。右肺体积缩小,右侧胸腔可见大量胸腔积液,双侧肺野可见多发大小不一结节状高密度影,肺门及纵隔可见多发肿大淋巴结影,部分可见融合,肺动脉包绕受压,右侧胸膜可见不均匀结节样增厚,左侧胸腔可见液体密度影,右侧腋窝可见多发团块状、结节状软组织密度影,最大的约7.8cmx5.4cm,可见分叶,部分可见融合并可见液化坏死,增强扫描实性部分平均CT值约54HU(图1)。
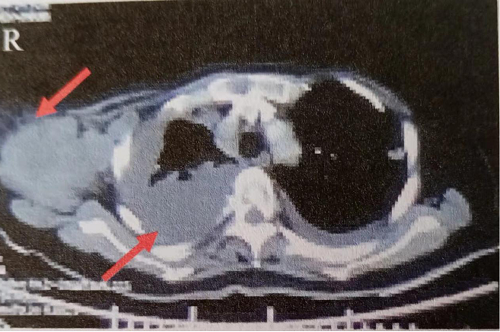
图1胸部CT示右侧大量胸腔积液,右侧腋窝软组织密度影7.8cmx5.4cm
2018年7月30日行右侧腋窝肿块穿刺活检病理示(纤维结缔组织)可见色素型肿瘤组织,考虑黑色素瘤转移。全身骨扫描示颅骨、脊柱、肋骨、骨盆及四肢长骨多发显像影异常浓聚,考虑骨恶性病变。
诊断:右拇指黑色素瘤术后复发、双肺转移、双侧胸膜转移、右侧胸腔积液、多发骨转移、多发淋巴结转移。
治疗:先后予替莫唑胺+奈达铂方案化疗及恩度治疗3周期,治疗效果明显,右侧胸腔积液基本消失,右腋窝淋巴结明显缩小(图2)。
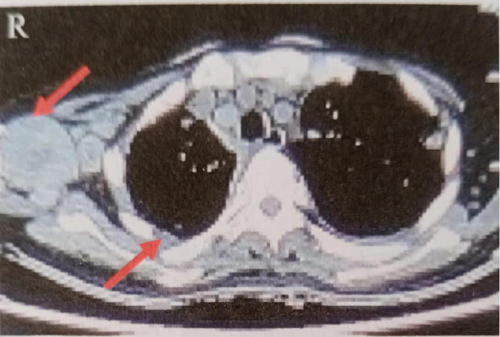
图2 胸部CT示右侧胸腔积液基本消失,右侧腋窝淋巴结缩小至3.6cmx1.8cm
讨论
恶性素瘤(malignant melanoma,MM),简称恶黑,是一种恶性程度极高的皮肤肿瘤,多发生于皮肤体表,占皮肤恶性肿瘤的7%~20%。国外统计其发病率占全部恶性肿瘤的1%~3%.白色人种恶黑发病率最高,澳大利亚昆士兰白人发病率高达28.4/10万,我国恶黑发病率约为0.8/10万。近年来许多国家皮肤恶黑的发病率在迅速增长,相应的病死率也在增加,发病年龄也愈来愈早,因此,受到人们重视。皮肤恶黑是起源于表皮的正常黑色素细胞或痣细胞的恶性肿瘤,主要发生在中老年,男女恶黑发病率无显著差异。发病部位:头颈部、躯干部、下肢各占约25%,上肢约占12.5%,其他部位占12.5%.但在不同性别中,部位分布差异很大,男性发生在躯干部的恶黑约占50%,女性则约有50%发生在四肢,尤其以下肢居多。发病部位与种族亦关系密切,黑人中恶黑发生在下肢的占60%多,且又有半数患者病变发生
在足底。
NCCN指南中将达卡巴嗪或替莫唑胺+恩度作为一线治疗方案。Cohen等采用BDV方案(BCNU、DTIC、VCR)治疗40例恶黑有效率为42.5%。传统化疗易产生抗药性,因此,寻求化疗增敏剂来加强细胞毒药物的杀伤作用或改变肿瘤细胞的抗药性已成为今后肿瘤化疗的一个新方向。对于晚期黑色素瘤,以PD-1抗体为基础的免疫治疗有效率明显高于化疗,相关研究也显示免疫哨卡抑制剂显著延长西方人转移性皮肤黑色素瘤的生存时间,患者的5年生存率高达54%,显著高于DTIC的5%~8%.目前晚期黑色素瘤的靶向治疗包含免疫治疗、个体化靶向治疗和化疗等。个体化靶向治疗和免疫治疗使得晚期黑色素瘤的1年生存率由化疗时代的30%提高到了73%~75%.
黑色素瘤的基因突变主要集中在MAPK信号通路,该通路最重要的2个靶点是CKIT和BRAF,这也是我国黑色素瘤患者比较明确的基因突变位点。此外,mTOR、CDK和GNAQ/11在我国黑色素瘤患者中的突变也在探索中。近年来,随着黑色素瘤中BRAF、c-KIT等重要癌基因的发现,晚期黑色素瘤的治疗也得到了极大的推动,以BRAF激酶抑制剂为主的靶向治疗成为研究热点。2011年 vemurafenib(BRAFV600E抑制剂)被美国食品与药物管理局(FDA)批准用于晚期黑色素瘤的治疗,标志着MM靶向治疗大门的开启。Vemurafenib 有效率约为50%,PFS期延长至半年左右,显著改善了晚期黑色素瘤患者的生存。随后的研究发现,vemurafenib 耐药后会出现“爆发式”进展,NRAS继发突变可能是“罪魁祸首”。因此,科学家们使用 dabrafenib(BRAFV600 抑制剂)联合trametinib(MEK抑制剂)治疗这部分患者,结果发现有效率进一步提高至70%左右,PFS期延长至12个月左右。FDA 于2013年批准dabrafenib 联合 trametinib 治疗晚期 BRAFV600突变的黑色素瘤患者。
索拉非尼是首个在中国成功上市的泛RAF激酶抑制剂,作用于RAF、血管内皮生长因子受体2(VEGFR-2)、VEGFR-3、血小板源性生长因子受体β(PDGFR-β)、c-KIT和FMS样的酪氨酸激酶3(FLT-3),可以同时抑制 RAF/MEK/ERK信号传导通路及肿瘤新生血管的形成。因此,我们为晚期黑色素瘤患者选用能覆盖BRAF靶点的药物-索拉非尼,黑色素瘤的免疫治疗目前已有了很多令人振奋的研究成果,也给黑色素瘤患者带来了福音,在国内逐渐得到了越来越多的认可。
Nivolumab阻断了PD-1对T细胞的抑制作用,从而激活肿瘤患者体内免疫效应细胞发挥杀瘤效应。2013年美国临床肿瘤学会(ASCO)年会上发布的一项临床研究显示,在107例接受治疗的黑色素瘤患者中,31%获得客观缓解。临床I期研究显示,全部5个剂量试验组均获缓解,中位生存期16.8个月,其中3kg/mg组患者的中位生存期为20.3个月,而随后的II期临床研究因明显延长OS而被提前终止。对BRAF突变的患者,抗PD-1治疗也有效。一项在BRAF突变患者中比较PD-1单抗和达卡巴嗪疗效的研究显示,抗PD-1治疗组1年生存率72.9%,而达卡巴嗪组仅42.1%.更令人惊讶的是,PD-1单抗联合细胞毒性T淋巴细胞相关抗原4(CTLA-4)单抗治疗的有效率达43%,1年生存率高达85%,2年生存率79%。
然而,PD-1单抗主要是通过重建机体免疫系统来达到识别和破坏肿瘤的目的,治疗起效缓慢,约4~6个月后肿瘤才开始缩小,甚至有的病例12个月后才起效。PD-1单抗的优势可能更多地体现在持续发挥疗效方面。所以,对于疾病进展迅速的晚期黑色素瘤患者,单独给予PD-1单抗治疗可能并不能迅速有效地控制病情,选择初始抗肿瘤效应较强的化疗及靶向治疗药物,可能是更合适的方案。基于靶向治疗和免疫治疗的临床有效性形式的不同,也有学者提出,联合应用靶向治疗和免疫治疗或许能实现互补,各取所长,但未来还需要进一步开展临床研究来验证,值得期待。
参考文献
1.Desantis CE,Lin CC, Mariotto AB, et al. Cancer treatment and survivorship statistics. CA Cancer J Clin,2014,64(4):252-271.
2. Grimaldi AM,Simeone E,Festino L, et al, Novel mechanisms andtherapeutic approaches in melanoma: Targeting the MAPK pathway. Discov Med,2015,19(107):455-461.
3. Paluncic J,Kovacevic Z, Jansson PJ, et al. Roads to melanoma:Key pathways and emerging players in melanoma progression and onco-genic signaling. Biochim Biophys Acta,2016,1863(4):770-784.
4.Kunz M,Holzel M. The impact of molanoma gonetics on treatment reAponHe and resistance in clinical and experimental studies. Cancer Meta8lasis Rev,2017,36 (1):53-75.
5. Ahmad N,Mohammad K,Ame P, et al. New Drug Combination Strategion in Melanoma: Current Status and Future Directions. Anticancer Res,2017,37(11):5941-5953.
6. Christiansen SA,Khan S,Gibney GT. Targeted therapies in combination with immune therapies for the treatment of metastaticmelanoma. Cancer J,2017,23(1):59-62.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





