病史
患者,男性,61岁,因“咳嗽10天,胸闷、气促1周”于2022年12月27日入院。
患者在入院10天前无明显诱因出现咳嗽,不伴咳痰咯血,无胸闷、胸痛等其他症状,1周前患者感咳嗽加剧伴有胸闷、气促,偶有胸痛。患者于2022年12月25日入住我院,查肺部CT示:左肺上叶占位,伴阻塞性炎症,肺不张,纵隔淋巴结肿大,左侧大量胸腔积液。12月26日,患者接受胸腔穿刺引流胸腔积液两次(单次500mL左右),自诉胸闷、气促稍有好转,患者为求进一步诊治再次来我院,门诊拟以“左肺上叶占位”收住入院。
患者为退休工人,无吸烟、饮酒习惯,无肿瘤家族史,婚育史、既往史无特殊。
体格检查:患者生命体征平稳,肺部听诊有左肺呼吸音偏低,未闻及干湿性啰音,余心脏、腹部及神经系统查体均为阴性。
入院后评估:ECOG/PS评分为1分,查血常规、血生化、肿瘤标志物、心肌酶谱、甲状腺功能、抗核抗体系列、心电图及心脏彩超等检查指标均正常。胸部增强CT示:左肺占位及左侧大量胸腔积液(图1)。头颅MRI平扫+增强+弥散、全腹部增强CT及全身骨骼ECT均未见明显异常。支气管镜检查示:气道通畅,未见明显异常。胸腔积液常规及生化检验示:渗出液,先后3次完善胸腔积液脱落细胞检查均未见肿瘤细胞。
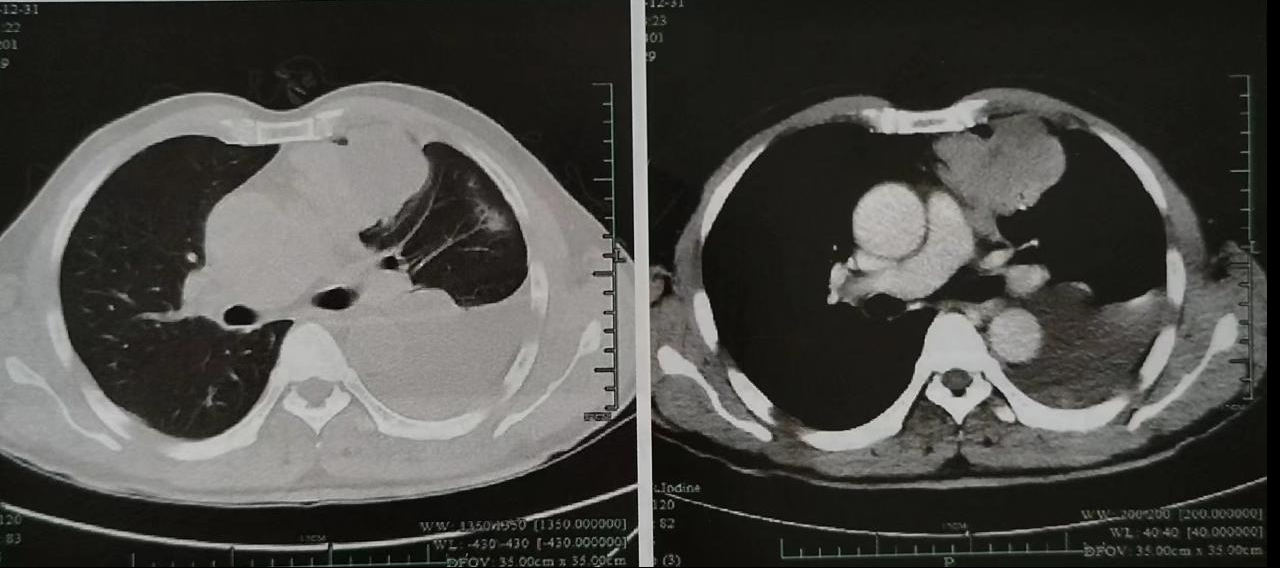
图1 治疗前胸部CT检查
2023年1月3日,患者接受CT引导下肺穿刺。2023年1月8日病理检查结果示(左肺穿刺标本)低分化癌,结合免疫组化检查较符合低分化鳞状细胞癌,免疫组化示:CK7(部分+),P63(+),TTF-1(-),CK5/6(部分+),Napsin A(-),Syn(灶+),CgA(-),CK泛(+)。EGFR、ALK及ROS1基因突变检测均为阴性,PDL1 TPS 5%。
临床诊断
左肺鳞癌(cT3N2Mla,IVA期);PS评分为1分。
临床治疗
患者于2023年1月16日接受了GC化疗方案(第1天、第8天吉西他滨1.7g+第1天卡铂600mg)+信迪利单抗200mg(第1天)治疗1个周期。
患者于2023年2月4日因“胸闷、气促3天”至我院急诊就诊。
复查胸部CT示:左肺癌伴左侧胸膜多发转移,两肺门及纵隔多发肿大淋巴结。对照2022年12月31日CT检查发现,左肺及左侧胸膜病灶较前稍减小,左侧胸腔积液伴左肺膨胀不全,较前进展(图2)。初步考虑患者胸闷、气促为胸腔积液增多引起的症状,急诊科医生予以胸腔穿刺引流胸腔积液以缓解患者症状。
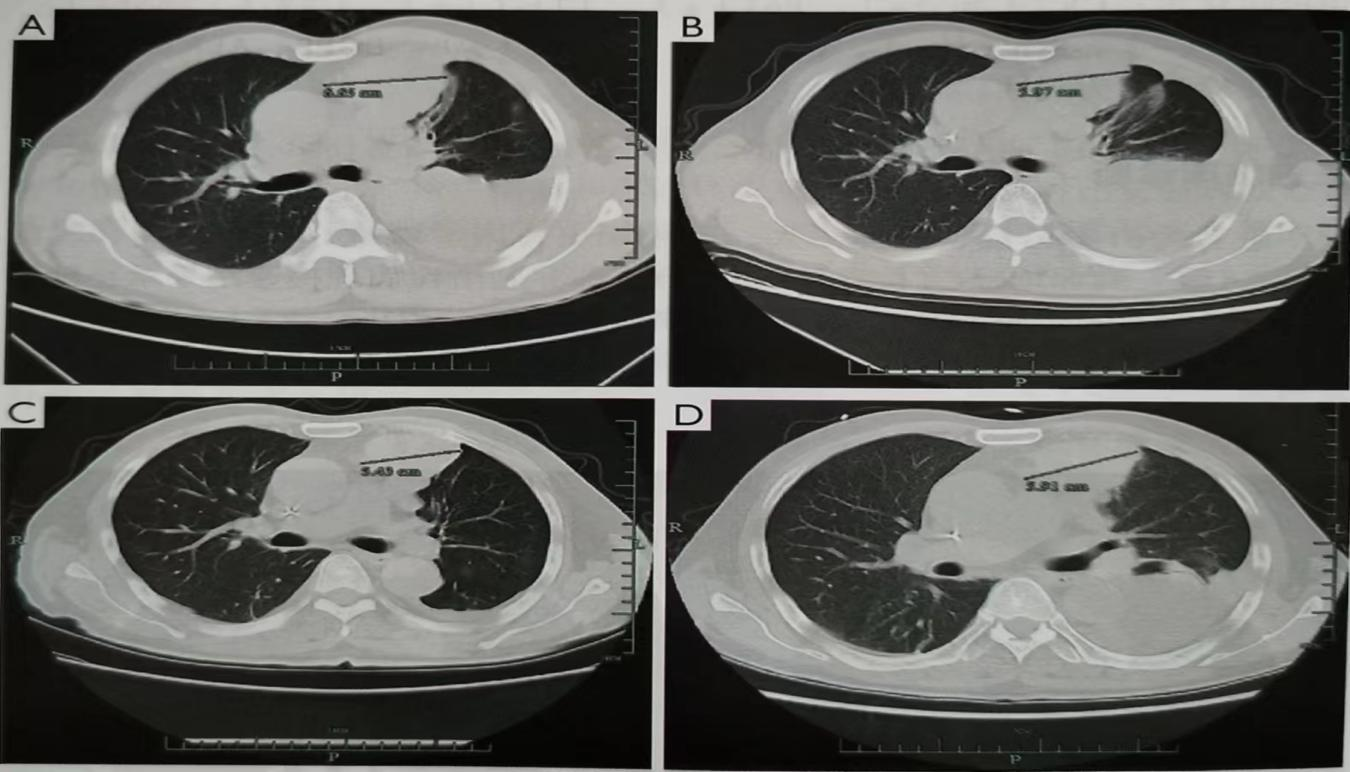
图2 患者治疗过程中胸部CT变化
(A)2022年12月31日,即治疗前;(B)2023年2月4日,即第1个周期治疗后19天;
(C)2023年3月24日,即第1个周期治疗后2个月余;
(D)2023年4月18日,即第1个周期治疗后3个月,胸腔积液再次增多。
同时继续完善患者各项检验检查,结果示:磷酸肌酸激酶3943U/L(38~174 U/L),谷草转氨酶168U/L(8~40 U/L),血清肌钙蛋白I 0.189ng/mL(0.000~0.060ng/mL),谷丙转氨酶182U/L(5~40U/L),乳酸脱氢酶1161U/L(109~245U/L),余胆红素及谷氨酰转肽酶正常。心电图示完全性右束支传导阻滞(图3)。超声心动图示升主动脉增宽,左心室舒张功能减退,二尖瓣、三尖瓣轻度返流。此时考虑患者出现肌炎(2级不良反应)、心肌炎(3级不良反应)和肝功能异常(3级不良反应),考虑可能与免疫治疗相关。
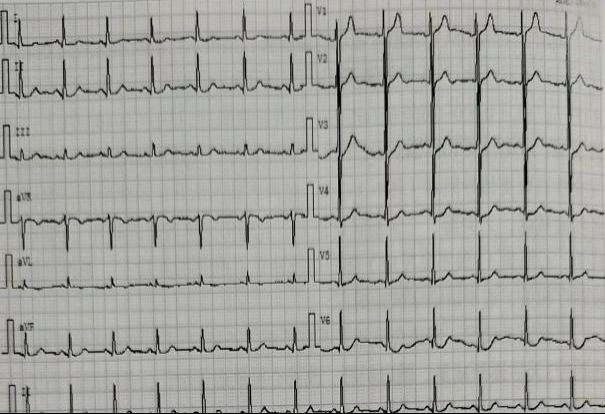
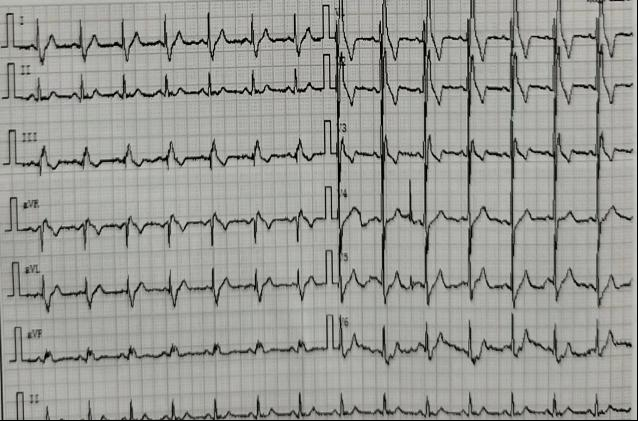
A治疗前心电图基本正常 (B):免疫治疗后出现完全性右束支传导阻滞
图3 患者免疫治疗前后心电图变化
根据以上情况,考虑免疫相关不良反应,予每8个小时糖皮质激素80mg冲击治疗3天后逐渐减量,辅以护肝、改善心脏供血等治疗,各项指标仍呈一过性显著升高后逐渐下降(图4)至正常,胸闷气急症状明显改善。
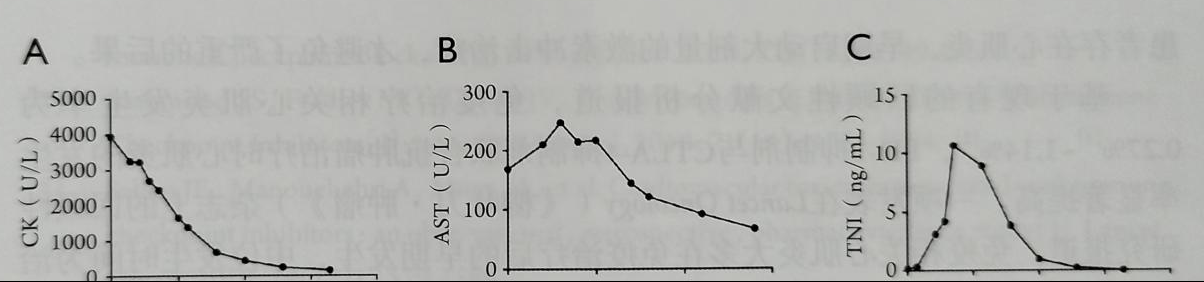
图4 治疗过程中患者各项指标变化情况
(A):具体指标包括磷酸肌酸激酶;(B):谷草转氨酶;(C):血清肌钙蛋白定量
治疗过程中,患者自2023年2月13日起出现明显的四肢乏力及麻木,不能步行,并有双眼睑下垂,视物模糊。查体示:双上睑下垂,眼球活动尚可,四肢肌力5级,无明显肌肉压痛。2023年2月15日,患者完成肌电图检查结果示:上、下肢周围神经损害,感觉较运动纤维受损明显。神经内科会诊考虑为吉兰-巴雷综合征(3级不良反应,与免疫治疗可能相关)。加用静脉注射人免疫球蛋白(25gx5d)治疗,同时予以甲钴胺针营养神经。患者四肢乏力及视物模糊症状于2023年2月23日开始逐渐好转,并于2023年3月4日出院。
疗效
患者的糖皮质激素方案在化疗联合信迪利单抗免疫治疗1个周期后因发生不良事件停药,但后续完善肺部CT复查示:患者肺部肿瘤病灶有持续缩小,最佳疗效为病情稳定,恶性胸腔积液得到控制。2023年4月18日,患者再次出现胸闷、气促症状,肺部CT提示胸腔积液较前明显增多,考虑疾病进展(图2)。患者在后续随访过程中,持续存在轻度眼睑下垂,心电图检查示持续存在完全性右束支传导阻滞的情况。2023年4月19日患者接受心脏MRI检查,结果示:心脏舒张期室间隔稍增厚,余心脏MRI未见异常征象。
后续治疗与随访
患者后续接受二线阿法替尼治疗,但1个月后疾病进展。三线接受紫杉醇(白蛋白结合型)治疗4个周期,最佳疗效为疾病稳定。四线口服安罗替尼维持治疗,疗效为疾病稳定,基本已控制。
总结与反思
免疫检查点抑制剂已在包括肺癌在内的多种肿瘤治疗中发挥抗肿瘤作用而得到较为广泛的使用。但是部分患者从免疫治疗中获益的同时,免疫治疗相关不良事件也引起越来越多的关注。与传统的化疗常见不良事件谱不同,免疫相关不良事件可以累及几乎全身任何组织与器官,其中免疫相关心肌炎、肺炎、神经炎都有一定的致死率,这一点尤其值得关注。
本例患者早期以胸闷、气促为临床表现,无肌肉疼痛、乏力等不适,同时患者有大量胸腔积液,初次评估考虑胸闷、气促为肿瘤相关症状所致。因血检发现肌酸激酶显著升高面引起警惕,后续完善血清肌钙蛋白及心电图检查考虑患者存在心肌炎,早期启动大剂量的激素冲击治疗,才避免了严重的后果。
免疫相关心肌炎表现
基于现有的回顾性文献分析报道,免疫治疗相关心肌炎发生率为0.27%[1]-1.14%[2],PD-1抑制剂与CTLA-4抑制剂联合抗肿瘤治疗时心肌炎的发生率显著提高。一项发表在Lancet Oncology(《柳叶刀·肿瘤》)杂志上的回顾性研究报道,免疫相关心肌炎大多在免疫治疗后的早期发生,中位发生时间为治疗后30天,死亡率高达50%[3]。
免疫相关心肌炎的临床表现多样,可以急性心力衰竭、胸痛、呼吸困难或心悸为首发症状,也可表现为心律失常,严重者可引发晕厥或猝死[4]。发生免疫相关心肌炎时,血清心肌生物标志物,如心肌肌钙蛋白I和肌酸激酶同工酶往往都会升高,但射血分数不一定下降;同时心脏MRI或者PET-CT检查可以便于发现心脏炎症的依据。而心肌活检病理检查可发现心肌和心脏传导系统中有丰富的CD4+T细胞、CD8+T细胞和CD68+巨噬细胞浸润[2]。免疫相关心肌炎诊断的金标准是依靠心肌活检或尸体解剖的病理诊断。在难以获取组织病理诊断时,诊断免疫相关心肌炎需要结合患者症状、血清心肌标志物、心电图以及心脏影像学检查来综合判断[5]。
免疫相关心肌炎的治疗
免疫相关心肌炎的治疗策略主要包括3个方面:暂停免疫治疗,予免疫抑制减轻炎症反应以及支持性治疗心脏并发症。一旦患者出现可疑的症状(如呼吸困难、胸痛、心悸),血清心肌生物标志物异常或心电图异常等表现,要警惕患者发生心肌炎的可能性,应立刻暂停免疫治疗,并进一步完善相关检查。在确诊或临床诊断免疫相关心肌炎后,其免疫抑制治疗需要给予高剂量糖皮质激素。ASCO和NCCN指南建议1~2mg/kg泼尼松静脉注射或口服,在一些重症/难治的病例的治疗上也建议予以甲泼尼龙500~1000mg静脉注射[7],直至患者临床情况稳定。如果患者对糖皮质激素疗效不佳,可考虑使用霉酚酸酯或英夫利昔单抗[7-8],但需注意到英夫利昔单抗在中度至重度心力衰竭患者中禁用。
免疫相关心肌炎往往伴随其他不良反应
此外,免疫相关心肌炎的患者中,有25%合并发生肌炎,还有10%~11%的患者合并存在重症肌无力[3]。本病例就是在激素治疗免疫相关心肌炎的过程中同时存在免疫相关肌炎,之后又出现吉兰-巴雷综合征。神经肌肉疾病也是免疫治疗过程中值得关注的免疫相关不良反应。重症肌无力、免疫治疗相关的肌病和吉兰-巴雷综合征是最为常见的3个免疫相关的神经肌肉不良反应[9]。值得注意的是,糖皮质激素作为绝大多数免疫相关不良反应的首选治疗方案,高剂量糖皮质激素可能会导致免疫相关神经肌肉疾病的出现以及恶化,这时候推荐使用静脉注射人免疫球蛋白或进行血浆置换[7]。
参考文献
[1] Johnson DB,Balko JM,Compton ML,et al. Fulminant Myocarditis with Combination Immune Checkpoint Blockade[J].N EnglJ Med,2016,375(18):1749-1755.
[2]Mahmood SS, Fradley MG,Cohen JV, et al. Myocarditis in Patients Treated With ImmuneCheckpoint Inhibitors[J].J Am Coll Cardiol,2018,71(16): 1755-1764.
[3]Salem JE,Manouchehri A,Moey M, et al. Cardiovascular toxicities associated with immunecheckpoint inhibitors: an observational, retrospective, pharmacovigilance study[J].LancetOncol,2018,19(12):1579-1589.
[4]Caforio AL,Sabine Pankuweit, Eloisa Arbustini, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis:a position statement of theEuropean Society of Cardiology Working Group on Myocardial and Pericardial Diseases[J].Eur Heart J,2013,34(33):2636-2648,2648a-2648d.
[5]Kindermann I,Barth C,Mahfoud F, et al.Update on myocarditis[J].J Am Coll Cardiol,2012,59(9):779-792.
[6]Hu JR,Florido R,Lipson EJ,et al.Cardiovascular toxicities associated with immune[9]checkpoint inhibitors[J].Cardiovasc Res,2019,115(5):854-868.
[7]Brahmer JR,Lacchetti C, Schneider BJ, et al.Management of Immune-Related AdverseEvents in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society ofClinical Oncology Clinical Practice Guideline[J].J Clin Oncol,2018,36(17):1714-1768.
[8]Lyon AR, Yousaf N, Battisti NM, et al. Immune checkpoint inhibitors and cardiovasculartoxicity[J].Lancet Oncol,2018,19(9):e447-e458.
[9]Kao JC,Brickshawana A,Liewluck T. Neuromuscular Complications of Programmed CellDeath-1(PD-1)Inhibitors[J].Curr Neurol Neurosci Rep,2018,18(10):63.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。