基本病史
患者,女,74岁,因“卵巢癌综合治疗后6年,脑转移术后1个月”于2021年1月19日入院。患者2014年11月因腹胀就诊外院,PET/CT提示肠系膜、大网膜、腹盆腔腹膜、子宫直肠陷窝及双侧卵巢多发性种植转移,双侧胸腔及腹盆腔积液。胸腔积液和腹水中均找见恶性肿瘤细胞,考虑卵巢来源。血清肿瘤标志物CA125 2539 IU/mL。诊断卵巢癌(胸腹腔转移)IV期,经紫杉醇联合卡铂化疗1次后,于2014年12月2日行“肿瘤减灭术”。术后病理示:双侧卵巢高级别浆液性癌,左侧输卵管、大网膜、结肠系膜、子宫直肠前壁及阑尾均可见癌组织。术后行依托泊苷联合顺铂腹腔化疗4次,以及多西他赛联合卡铂静脉化疗6次。化疗结束后CA125降至正常范围。后定期复查,病情稳定。2020年11月患者出现头晕、头痛。PET-MRI示:右侧枕叶占位性病变(3.7cmx2.3cmx3.2cm,SUVmax 11.7),未见其他远处转移征象,考虑脑转移可能。于12月16日行“右侧后纵裂经楔前叶入路脑干旁肿瘤切除术”,术后病理符合高级别浆液性癌转移,基因检测发现BRCA2基因11号外显子p.Q1129*无义突变(胚系)。诊断:卵巢癌术后(胸膜腔、脑转移)IV期,BRCA2突变。术后2周左右患者出现神志淡漠、嗜睡、刺激后无睁眼反应;CT提示:术后改变,术区少量出血。给予加强脱水后神志恢复,可自主睁眼,后很快再次出现神志模糊,对声音刺激无反应,对疼痛刺激有反应,有时可自主睁眼,不能对答,吞咽困难,大小便失禁,予以留置鼻饲营养管和导尿管。
辅助检查
头颅MRI示:右顶枕颅脑术后,术区边缘出血信号,广泛软脑膜强化及右侧小脑直径7.5mm的异常强化小结节,脑室系统及脑沟裂不同程度扩大(图1)。腰椎穿刺脑脊液见恶性肿瘤细胞,符合卵巢癌脑膜转移表现。肿瘤标志物:CEA 5.80ng/mL,CA125 45.50IU/mL。血生化指标除轻度转氨酶增高(ALT 97U/L,AST 35U/L)外,余未见明显异常。诊断:卵巢癌术后(胸膜腔、脑、脑膜转移)IV期,BRCA2突变。
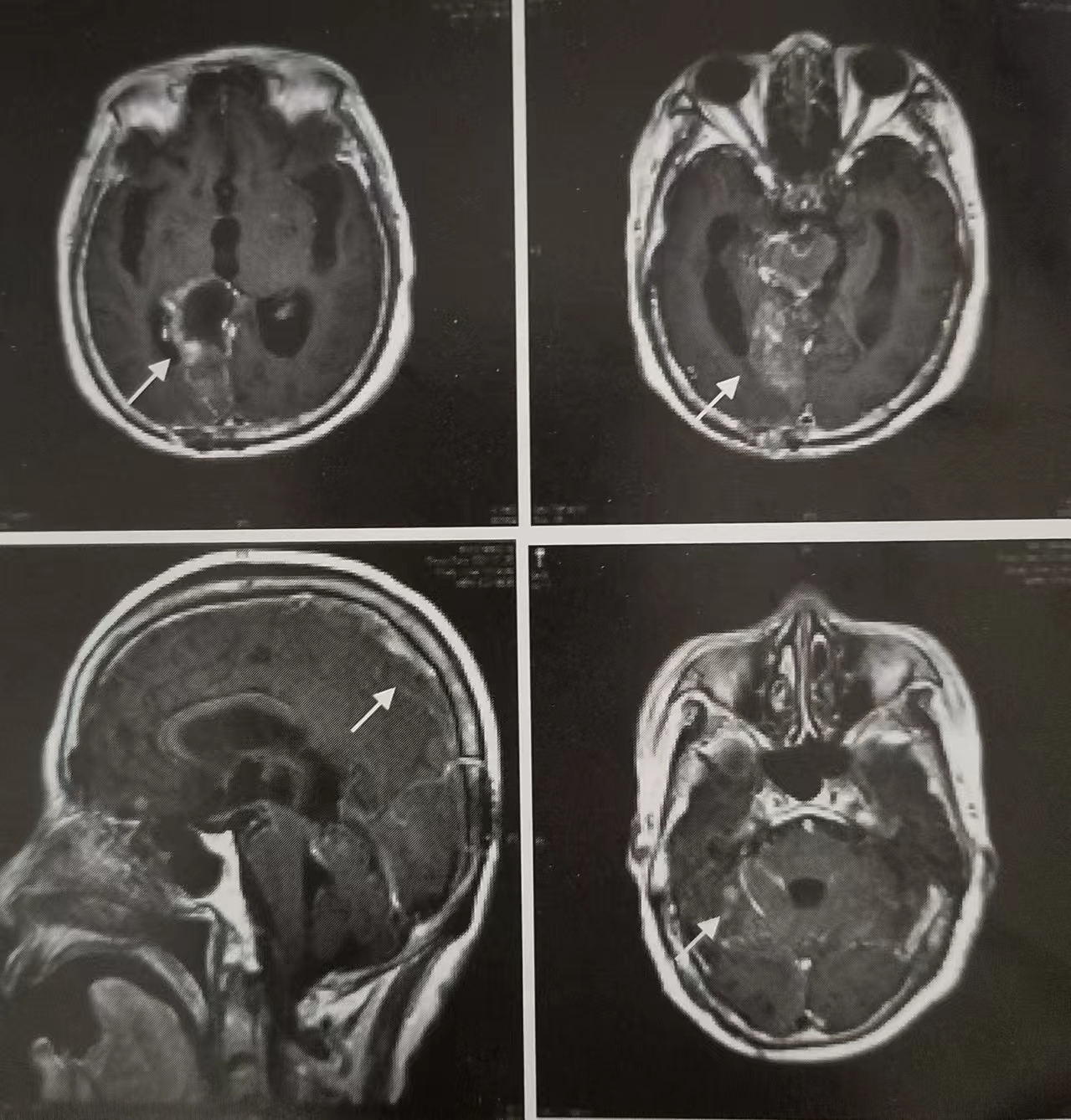
图1 头颅MRI见脑膜强化及小脑转移灶((T1加权)。
诊疗经过
2021年1月19日开始给予鼻饲奥拉帕利150mg,2次/日,后逐渐加量至300 mg,2次/日;2021年2月8日患者家属开始自行加量至450mg,2次/日,其间出现骨髓抑制(血红蛋白最低至61g/L,中性粒细胞计数最低至1.2525x10°/L)无发热,给予暂停奥拉帕利、输血、升白细胞治疗后恢复。考虑奥拉帕利骨髓抑制不良反应,并初步评估患者影像学改善。2021年3月18日开始更换为尼拉帕利100mg/d,并逐渐加量为200mg/d至2021年4月21日,后出现骨关节痛及III度骨髓抑制(中性粒细胞计数0.9.97x10°/L),经暂停尼拉帕利、升白细胞治疗后恢复,于5月19日改回奥拉帕利300mg,2次/日,其间检测未出现明显骨髓抑制等不良反应。 在奥拉帕利治疗2个月后(2021年3月下旬)患者由浅昏迷逐渐转为嗜睡,能简短对答,4月初转为神志清晰,对答基本切题,吞咽功能略有恢复,可进流质,但仍不能自主排便,仍卧床,坐位不能,左侧肢体肌力II级,右侧肢体肌力III级。治疗5个月后患者吞咽功能基本恢复,可自主坐位,不能站立,大小便仍不能自主,左侧肢体肌力II~III级,右侧肢体肌力V级。后患者症状持续稳定。 奥拉帕利治疗1个月后复查头颅MRI提示小脑转移灶消失,颅内脑膜转移灶强化减弱(图2),治疗3个月复查PET/CT提示右侧脑室内软组织影、右侧脑室旁水肿伴FDG代谢欠均匀(未见明显FDG代谢异常增高),余全身未见复发转移灶。后每2~7个月不定期复查头颅MRI,提示颅内病灶稳定,无新发病灶。 治疗3个月后行腰椎穿刺检查,脑脊液生化提示:蛋白质减少,葡萄糖降低,氯化物回升,脑脊液中仍可见肿瘤细胞。血清肿瘤标志物CA125和CEA在治疗后逐渐下降至正常范围。
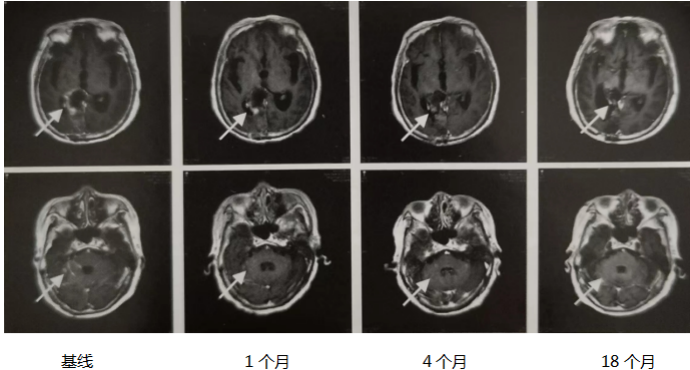
图2 PARP抑制剂治疗后MRI显示脑膜强化减弱,小脑转移灶消失(T1加权)
2022年12月初,患者逐渐出现肌力减退、吞咽功能减退,肿瘤标志物CA125升高至54.9IU/mL,头颅MR提示脑室扩张,腰椎穿刺检查提示脑脊液中大量肿瘤细胞浸润。其间患者感染新型冠状病毒(轻型),出现高热,并发吸入性肺炎,于2022年12月28日死亡。从诊断脑膜转移时起的生存时间为23个月。
讨论
卵巢癌是妇科肿瘤死亡的首位原因[1]。尽管大多数患者经过以铂类为基础的初始治疗后可获得较好的临床缓解,但仍有70%的患者在2年内复发。卵巢癌最常见的播散部位是腹盆腔,脑转移的发生率仅2%左右,多数发生在脑实质,脑膜转移非常罕见。在一项回顾性分析中,13126例卵巢癌患者中仅有8例出现脑膜转移(0.06%)[2]。发生脑膜转移后疾病进展快,预后差,不经治疗的患者中位生存期为4~6周。脑膜转移的治疗尚无共识,常见的治疗手段有:手术、全脑或局部放疗、系统化疗、分子靶向治疗及鞘内注射化疗。
PARP抑制剂作用机理 多腺苷二磷酸核糖聚合酶(poly ADP ribose polymerase,PARP)抑制剂的发展为卵巢癌的治疗带来巨大变化。PARP在DNA单链碱基切除、修复过程中发挥关键作用。PARP1识别并修复DNA单链断裂(single-strand breakage,SSB)损伤,PARP抑制剂将PARP1结合并捕获在断裂的DNA上,引起DNA单链损伤积累,导致DNA双链断裂(double-strand breakage,DSB)增多。在正常细胞中,断裂的双链可以通过同源重组修复(homologous recombination repair,HRR),但在有同源重组修复缺陷(如BRCA1/2突变)的细胞中,DNA损伤无法修复,从而形成“合成致死”效应,最终导致细胞死亡[3]。
PARP抑制剂疗效显著,不良反应可耐受 PARP抑制剂在卵巢癌的维持治疗及复发患者的治疗中展示出较好的疗效,但在卵巢癌脑转移中的治疗数据有限,仅有少数病例报道提示PARP抑制剂在卵巢癌脑转移中有一定的疗效,结合化疗、手术或放疗,其中位PFS>12个月。临床前研究提示,相较于其他PARP抑制剂,尼拉帕利能透过血脑屏障,因其有较高的生物膜通透性,能克服血脑屏障的外排机制(如P-糖蛋白),在颅内能维持较高的浓度[4]。PARP抑制剂在脑膜转移治疗中的作用尚未有临床研究进行探索,仅有少数文献报道。 本例患者卵巢癌术后6年出现脑实质及脑膜转移,既往对铂类治疗敏感,全身治疗应首选含铂方案化疗,但患者PS评分差,化疗风险较大,基因检测提示患者有致病性BRCA2突变,综合考虑后,给予PARP抑制剂治疗。经过PARP抑制剂奥拉帕利治疗2个月后,患者神经系统症状明显改善,意识状态由浅昏迷逐渐转为神志清醒,生活质量得到了明显的改善,并且在后续更换为尼拉帕利期间,仍能持续缓解,最终获得了23个月的生存期。既往PARP抑制剂的临床研究数据显示,最常见的不良反应包括疲劳、胃肠道反应及血液学毒性,其不良反应以轻度或中度为主,其中3~4级不良反应以血液学不良反应(贫血占5%~41.6%、血小板减少占1%~34%、中性粒细胞减少占4%~33.6%)等为主,且大部分不良反应可通过减量、对症治疗控制[5]。本例患者用药期间出现III度骨髓抑制,对症治疗后好转,显示出良好的耐受性。有研究探索了影响脑膜转移癌预后的因素,提示:脑膜转移的发生时间距离患癌时间<1年,年龄>50岁,KPS评分低,脑脊液细胞学治疗反应不良、脑脊液蛋白升高等是脑膜转移的不良预后因素[6]。但本例患者虽然高龄,KPS评分低,且治疗后脑脊液细胞学未转阴,但仍取得了较为良好的疗效,显示PARP抑制剂在治疗卵巢癌中枢神经系统转移中有一定的潜力。
参考文献 [1] SIEGEL R L, MILLER K D, FUCHS H E,et al. Cancer statistics,2022.CA Cancer J Clin,2022,72(1):7-33. [2] MILLER E,DY I,HERZOG T.Leptomeningeal carcinomatosis fromovarian cancer [J].Med Oncol,2012,29(3):2010-201. [3] CONNOR MJ O. Targeting the DNA damage response in cancer [J]Mol Cell,2015,4(60):547-560. [4] SUN K,MIKULE K, WANG Z, et al. A comparative pharmacoki-netic study of PARP inhibitors demonstrates favorable properties forniraparib efficacy in preclinical tumor models [J].Oncotarget,2018,9(98):37080-37096. [5]孙北华,刘继红,谢幸,等.卵巢癌PARP抑制剂临床应用指南(2022版)[J].现代妇科学进展,2022,31(8),561-572. [6] OECHSLE K,LANGE-BROCK V, KRUELL A, et al. Prognosticfactors and treatment options inpatients with leptomeningeal metastases ofdifferent primary tumors: a retrospective analysis [J].J Cancer ResClin Oncol,2010,136(11):1729-1735.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





