塔拉妥单抗为代表的双特异性T细胞衔接蛋白(BiTE)已经成为了小细胞肺癌二线治疗的重要选择[1]。尽管初步的疗效可观,由于随访时间较短,所以其长期疗效目前还是未知,这也同时也是大家关心的问题。最近权威的JCO(Journal of Clinic Oncology)上公布了塔拉妥单抗用于小细胞肺癌治疗随访1年的数据[2],下面,我们将对这些数据从临床应用角度进行分析,希望能够对大家提供一定的帮助。
塔拉妥单抗的长期疗效
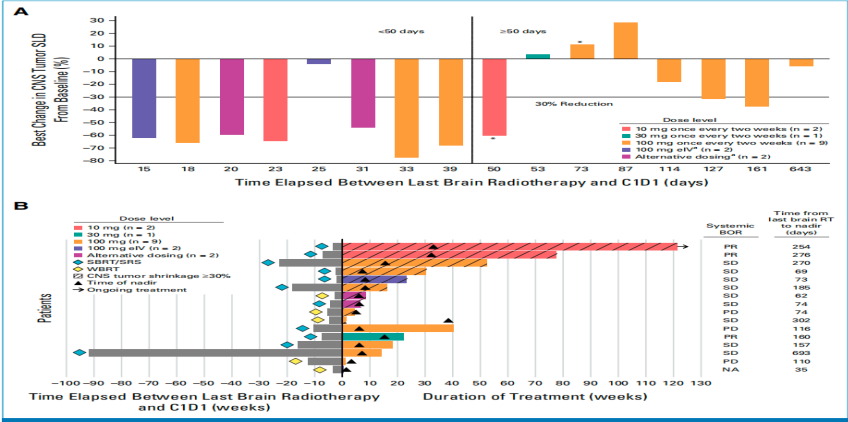
结合目前已经进行的塔拉妥单抗在小细胞肺癌中的几项临床研究,塔拉妥单抗被分为了3种不同的给药方式,分别为每两周给药一次,每三周给药一次以及每周期的第1天,第8天给药(每21天为一个给药周期)的给药模式[3]。在随访了近1年之后,目前公布的塔拉妥单抗在广泛期小细胞肺癌患者二线治疗中的客观缓解率(ORR)为25.0%;中位缓解持续时间(mDOR)为11.2个月,中位无疾病进展生存时间(mPFS)为3.5个月,中位总生存期(mOS)为17.5个月[2]。
由于每两周给药1次已经被设定为后续研究推荐的给药方式,进一步 对每两周给药一次的方案进行疗效分析时发现,患者采用该方案的有效率最高,ORR可达35.3%,mDOR为14.9个月,mOS为20.3个月。此外,在长期的疗效上,有近30%患者的疾病控制时间(疗效在CR,PR以及SD)在1年以上,表明这部分患者很有可能是治疗的优势人群。
脑转移人群也能从治疗中获益
该研究入组了约25%脑转移的患者,按照修订的神经-肿瘤脑转移疗效评估标准[4],小细胞肺癌脑转移患者接受塔拉妥单抗治疗之后,脑转移病灶缩小幅度大于30%患者的比例达到了62%以上,患者的疾病控制率为87.5%,中位疗效持续时间为7.4个月。表明,塔拉妥单抗很可能对脑转移患者也有效。进一步的分析发现,几乎所有有效的患者既往都曾接受过颅脑放疗,表明塔拉妥单抗很可能同放疗具有协同效应。至于其准确的抗脑转移作用机制,目前还是未知,有待进一步的研究以阐明。
治疗的优势人群
除了一般人群的疗效以外,进一步的研究发现,有近15%的患者持续疾病控制时间达到1年以上,其中有8名患者的疾病控制时间达到了2年[2]。对这部分患者的特征进行分析后发现,治疗期间疗效为CR,PR以及SD的患者同疗效为PD的患者相比,肝转移的比例较低(32% vs 45.3%),基线肿瘤的负荷也较低(基线中位肿瘤长径总和 47mm vs 89 mm),患者的体能评分状况也更好(60% vs 39.6%),表明通过观察治疗期间患者的起效特点以及在治疗前注重人群的筛查可以选择潜在的治疗优势人群。
治疗的毒副反应
除了持久的疗效以外,对于一个抗肿瘤新药而言,毒副反应也是一个值得关注的重点问题,了解其发生特点也对临床治疗很有帮助。塔拉妥单抗用于小细胞肺癌治疗期间,在发生率大于20%以上的毒副反应中,发热与恶心缓解比较快(中位缓解时间分别为2天与10天),乏力,食欲减退以及吞咽困难需要更长的时间缓解(中位缓解时间分别为51天,72天以及273天)。
此外,需要注意的是,除了治疗短期会出现毒副反应以外,有近35%的患者在治疗1年之后出现了迟发性的毒副反应,主要为1度或者2度的血细胞减少,乏力等。与此同时,部分脑转移的患者接受治疗时,也出现了免疫效应细胞相关的神经综合征(ICANS),其总体发生率为10%左右,严重程度不超过5%。表明在治疗期间还是需要关注一些以激活免疫发挥作用的抗体特有的毒副反应,比如细胞因子释放综合征(CRS) ,ICANS等[5],以尽可能确保治疗安全。
结语
结合目前已经公布的长短期疗效数据,以塔拉妥单抗为代表的双特异性T细胞衔接蛋白(BiTE)确实有望成为打破小细胞肺癌治疗瓶颈的一把利器,为一部分患者带来长期的生存获益。但是,塔拉妥单抗目前在小细胞肺癌中的临床应用还是存在一些问题,比如药物的可及性,耐药的机制,治疗优势人群的选择,应用范围的拓展等,只有这些问题得到解决,小细胞肺癌的患者才能从塔拉妥单抗的治疗中得到实实在在的生存获益。
参考文献
[1] Goebeler ME, Stuhler G and Bargou R. Bispecific and multispecific antibodies in oncology: opportunities and challenges. Nat Rev Clin Oncol 2024; 21: 539-560.
[2] Dowlati A, Hummel HD, Champiat S, Olmedo ME, Boyer M, He K, Steeghs N, Izumi H, Johnson ML, Yoshida T, Bouchaab H, Borghaei H, Felip E, Jost PJ, Gadgeel S, Chen X, Yu Y, Martinez P, Parkes A and Paz-Ares L. Sustained Clinical Benefit and Intracranial Activity of Tarlatamab in Previously Treated Small Cell Lung Cancer: DeLLphi-300 Trial Update. J Clin Oncol 2024; Jco2400553.
[3] Ahn MJ, Cho BC, Felip E, Korantzis I, Ohashi K, Majem M, Juan-Vidal O, Handzhiev S, Izumi H, Lee JS, Dziadziuszko R, Wolf J, Blackhall F, Reck M, Bustamante Alvarez J, Hummel HD, Dingemans AC, Sands J, Akamatsu H, Owonikoko TK, Ramalingam SS, Borghaei H, Johnson ML, Huang S, Mukherjee S, Minocha M, Jiang T, Martinez P, Anderson ES and Paz-Ares L. Tarlatamab for Patients with Previously Treated Small-Cell Lung Cancer. N Engl J Med 2023; 389: 2063-2075.
[4] Chou J, Egusa EA, Wang S, Badura ML, Lee F, Bidkar AP, Zhu J, Shenoy T, Trepka K, Robinson TM, Steri V, Huang J, Wang Y, Small EJ, Chan E, Stohr BA, Ashworth A, Delafontaine B, Rottey S, Cooke KS, Hashemi Sadraei N, Yu B, Salvati M, Bailis JM, Feng FY, Flavell RR and Aggarwal R. Immunotherapeutic Targeting and PET Imaging of DLL3 in Small-Cell Neuroendocrine Prostate Cancer. Cancer Res 2023; 83: 301-315.
[5] Paz-Ares L, Champiat S, Lai WV, Izumi H, Govindan R, Boyer M, Hummel HD, Borghaei H, Johnson ML, Steeghs N, Blackhall F, Dowlati A, Reguart N, Yoshida T, He K, Gadgeel SM, Felip E, Zhang Y, Pati A, Minocha M, Mukherjee S, Goldrick A, Nagorsen D, Hashemi Sadraei N and Owonikoko TK. Tarlatamab, a First-in-Class DLL3-Targeted Bispecific T-Cell Engager, in Recurrent Small-Cell Lung Cancer: An Open-Label, Phase I Study. J Clin Oncol 2023; 41: 2893-2903.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。