病例资料
患者,男,58岁,因“咳嗽、咳痰1个多月”于2013-10-18就诊。患者于2013年9月出现咳嗽、咳痰,痰白色黏稠,无痰血。入院后,完善相关检查。2013-10-26胸部CT(图1):右上肺后段分叶状结节,首先考虑周围型肺癌,建议结合穿刺活检。纵隔及双肺门未见明显的肿大淋巴结。2013-10-29CT引导下穿刺活检提示:(右肺上叶)非小细胞癌。支气管镜、腹部CT、骨ECT及颅脑MRI未见转移病灶。肿瘤标志物、心肺功能未见异常。初步诊断:右肺上叶非小细胞癌,周围型,cT1N0M0,IA期。
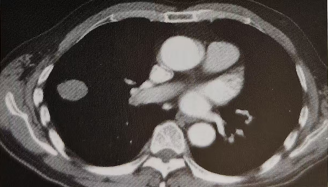
图1.2013-10-26胸部增强CT可见右肺肿瘤
第一次MDT讨论:患者早期肺癌,首次如何治疗?
影像科:右肺上叶肺门旁可见一大小约2.8cm×2.6cm的分叶状结节影,内密度大致均匀,增强后呈中等度强化,右肺上叶支气管显示狭窄闭塞,其外侧见片状模糊影,首先考虑右肺中央型肺癌伴右上肺阻塞性炎症;右肺门数枚小淋巴结显示,形态较饱满。影像分期:T1cNOM0。
胸外科:该患者的临床诊断为Ia期,若无心肺功能等特殊禁忌,首先选择手术切除病灶。手术方式可选择全麻胸腔镜下右肺上叶切除术+肺门纵隔淋巴结清扫术。
放疗科:除了手术以外,SBRT也是早期非小细胞肺癌的治疗选择。基于NCDB数据库的大宗人群回顾性研究以及随机对照研究(STARS/ROSEL)的分析结果提示SBRT不劣于手术治疗:3年0S上,SABR优于手术(95%vs79%,P=0.037);3年RFS上,SABR与手术类似(86%vs80%,P=0.54);在毒性方面,SBRT低于手术。即使有这样的结果,目前的NCCN指南仍然规定:除了做临床试验,不建议对早期可切除的NSCLC T1-2NOM0患者进SBRT。因此,目前对早期非小细胞肺癌使用SBRT的方法主要应用在那些存在手术禁忌的患者身上。而本案例中患者相对年轻,有良好的心肺功能,能够承受肺叶切除加系统性淋巴结清扫,因此建议该患者接受肺癌根治手术,而不推荐进行立体定向放疗。
治疗情况
2013-11-06行剖右胸右肺上叶切除术+肺门纵隔淋巴结清扫术,手术及恢复过程顺利。术后病理:右上肺叶低分化腺癌(瘤体2.6cm×2.4cm×2.0cm),未见脉管瘤栓及神经侵犯,癌转移至(12组)0/3只、(11组)0/2只、(10组)2/6只、(7组)0/3只、(4R组)0/2只、(2组)0/3只淋巴结。免疫组化结果:TF-1(+),NapsinA(+),P63(-),P40(-),Ki-67(+),30%,CK7(+)。术后病理分期:pT1bN1M0,ⅡA期。
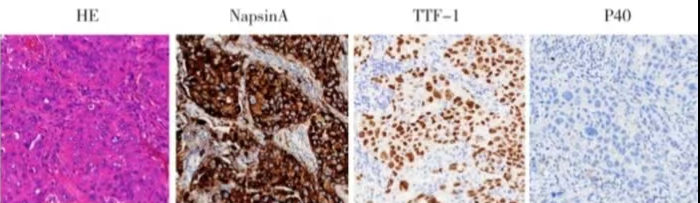
图2.术后病理低分化腺癌
第二次MDT讨论:患者术后选择何种方式进行辅助治疗?
肿瘤内科:根据肺癌根治术后的辅助治疗,2008年LACE研究发现,术后辅助化疗可以给患者带来生存获益,5年0S的绝对获益率为5.49%。Ⅱ期和Ⅲ期患者有显著的生存获益,在亚组分析显示,只有长春瑞滨与铂类药物联合(NP方案)给患者带来OS获益。2019年ASCO会上,日本JIPANG研究探索了标准NP方案与目前针对非鳞非小细胞肺癌使用常见的培美曲塞联合铂类方案用于辅助化疗的差异:培美曲塞/顺铂v长春瑞滨/顺铂,用于完全切除的Ⅱ-ⅢA期非鳞非小细胞肺癌辅助化疗的随机Ⅲ期临床研究。虽然这项Ⅲ期临床研究未达到终点,但是在NSCLC患者术后辅助化疗中培美曲塞联联合顺铂和NP方案比具有相似的疗效与更好的耐受性。在NCCN指南中ⅡB及以上分期均需术后辅助治疗,方案推荐4周期含铂双药方案,对于非鳞非小细胞肺癌首先推荐培美曲塞联合顺铂,对于鳞癌首先推荐吉西他滨或多西他赛联合顺铂。如果不能耐受顺铂,也可以选择卡铂。在IB-ⅡA期,具有高危因素的可考虑辅助治疗。高危因素包括低分化肿瘤、血管侵犯、楔形切除、肿瘤>4cm、脏器胸膜累及和淋巴结状态不明(Nx)。
放疗科:该患者完成了剖右胸右肺上叶切除术+肺门纵隔淋巴结清扫术,切除了肺门、纵隔6站淋巴结,其中第10组淋巴结2颗阳性,纵隔2组淋巴结阴性,为R0切除术后,对于只存在肺门淋巴结转移的患者是没有必要进行术后辅助放疗的。因为根据对ANITA研究的亚组分析显示术后辅助放疗对进行R0切除的术后病理为N1的患者的生存是有负面影响的,中位生存时间分别为观察组的93.6个月s放疗组的46.6个月。因此,对于这样R0切除又经历了肺门纵隔淋巴结清扫的非小细胞肺癌患者,不建议也不需要进行术后辅助放疗。
治疗情况
患者于2013-12-05至2014-02-10行4周期AP方案辅助化疗:培美曲塞二钠1g静滴d1+顺铂45mg静滴d1-3,Q3W。后患者定期复查。
患者于2018-11-14当地医院复查胸部CT提示:纵隔多发淋巴结肿大,遂来院就诊。2018-11-18支气管镜检查:右上叶支气管手术残端未见新生物,第4组淋巴结EBUS-TBNA中找到非小细胞癌细胞。2018-11-25胸部强化CT示:右肺癌术后,纵隔内淋巴结(4R组)转移,图2。颅脑MRI、肿瘤标志物等检查未见异常。目前诊断:右肺腺癌术后,纵隔淋巴结转移,rTON2M0,ⅢA期。
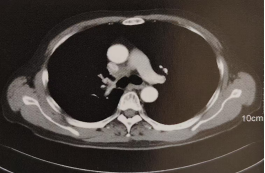
图3.2018-11-20胸部增强CT纵隔4R区肿大淋巴结
第三次MDT讨论:患者术后复发,如何进行下一步治疗。
胸外科:右上肺癌术后,目前4R组淋巴结出现了复发,病理明确为非小细胞癌。患者此处的淋巴结复发,不排除初次手术清扫不彻底,如奇静脉弓内侧残留部分淋巴结的可能性。患者目前的疾病处于区域复发状态,根据NCCN指南,可以选择手术切除及根治性放化疗。此时,应首先判断手术根治性切除的可能性。患者的右侧胸腔及4织组淋巴结处经前次手术,目前的解剖结构已改变且极有可能存在明显粘连,手术难度大:而且,CT提示4R组淋巴结与上腔静脉之间的间隙不清,有可能已侵犯腔静脉壁。以上两者均提示手术根治性切除病灶的难度较大,存在无法RO切除的可能性。因此,建议患者首选放疗。
肿瘤内科:患者术后出现纵隔淋巴结转移,病理也进一步证实,如果能进一步免疫组化,可明确分型的具体类型。考虑患者目前仍处于局部复发,治疗原则为根治性放化疗。现在,PACIFIC研究证实对于Ⅲ期非小细胞肺癌患者放化疗后可行Durvalumab免疫维持治疗。JT0杂志公布了该研究的最新数据。数据显示,免疫维持组vs观察组的中位0S分别为47.5个月和29.1个月(HR=0.71),48个月的0S率分别为49.6%和36.3%,两组的中位PFS分别为17.2个月和5.6个月(HR=0.55),48个月的PFS率分别为35.3%和19.5%。
放疗科:该患者目前出现了纵隔4R区淋巴结肿大,对于这样以往有肺癌病史并经过肺癌根治术的患者。该患者经气管镜下4R组淋巴结穿刺活检后被确诊为非小细胞肺癌,为右肺腺癌术后纵隔淋巴结转移,分期为TON2M0,ⅢA期。虽然是属于转移,但是疾病仍然是区域性疾病,有根治的可能性,手术或者放疗等局部治疗是第一选择。由于肿大淋巴结存在淋巴结包膜外侵犯,无法进行手术根治,同步放化疗成为治疗首选;放疗的趋势是选择调强放疗,针对纵隔内转移淋巴结进行累及野照射,由于是腺癌,同步化疗方案可以选择等效低毒的培美曲塞+顺铂/卡铂方案。
治疗情况
2018-12-09至2019-01-23行同步放化疗,GTV为纵隔内淋巴结(4R组)转移病灶。CTV为纵隔2R区、纵隔4R区、右侧支气管残端和右侧肺门淋巴引流区,GTV均匀外放O.5cm而形成PGTV,CTV均匀外放0.5cm而形成PTV,PGTV剂量60Cy/30F/6w,PGTV剂54Gy/30F/6w。危及器官剂量有肺平均剂量:762cGy,V20=15%,V30=9%,脊髓Dmax=4070cGy,心脏V40=5%。 2018-12-09、2018-12-30、2019-01-21行同步化疗3周期:培美曲塞0.9g静滴d1+卡铂600g静满d1,Q3W。放疗后1个月复查胸部CT提示:淋巴结明显缩小,见图3,疗效为PR。治疗后进入门诊随访。
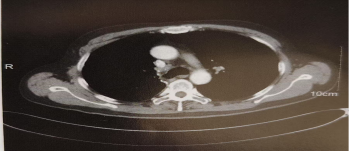
图4.2019-02-06胸部增强CT纵隔4R区淋巴结缩小
2023年7月,患者于当地医院复查胸部CT,结果提示两肺及纵隔淋巴结转移,遂至我院就诊。2023-07-15胸部增强CT示(图4):两肺有多枚小结节,右肺明显,考虑转移;双侧锁骨区结节,纵隔内有数枚淋巴结影,考虑转移。2023-07-18右侧锁骨上窝淋巴结穿刺活检病理示:(右锁骨上结)纤维组织内转移或浸润性低分化癌,分子检测结果:EGFR基因(ARMS法)(肿瘤样本中检测到EGFR Ex20ins突变。免疫组化:ALK(D5F3)(-)、P40(-)、TTF-1(+)。颅脑MR1、肿瘤标志物等其余检查未见明显异常。目前诊断:右肺腺癌术后,两肺转移、纵隔及锁骨上淋巴结转移,rTON3M1a,IVA期,EGFR Ex20ims突变。
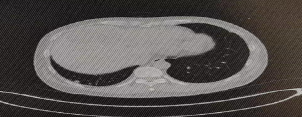
图5.2023-07-15胸部CT可见肺内转移瘤
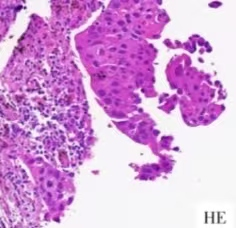
图6.锁骨上淋巴结穿刺活检病理
第四次MDT讨论:患者肿瘤出现远处转移,下一步该如何治疗?
影像科:右肺癌术后纵隔淋巴结转移经放疗后复查双肺胸膜下新出多枚细小结节,结清;纵隔1区及2R区有多枚增大的淋巴结影,较前新出;结合病史,均考虑转移所致的可能性大。
肿瘤内科:在肺癌靶点突变中最常见的一类基因突变类型是EGFR。中国非小细胞肺癌患者的突变率为35%-40%,常见突变位点发生在18、19、20和21号外显子上。其中,19号外显子缺失突变占45%,21号外显子L858R点突变占40%-45%,这两种突变为常见突变。除19与21号外显子外,在EGFR突变中有一种亚型,被称为EGFR Ex220插入突变(EGFR Ex20ims),在EGFR突变中占4%-10%。此类患者使用传统的一代、二代EGFR-TKI的疗效均不理想,导致预后比较差。在中国,目前还没有针对EGFR Ex220ins的靶向药物上市,所以当前针对EGFR Ex20is突变的患者,一线治疗上还是首选化疗治疗。通常选择培美曲塞联合铂类化疗,或者化疗联合抗血管生成靶向药贝伐珠单抗(也属于常用方案)。
治疗情况
2023-08-01至2023-08-22予以行AC+贝伐珠单抗方案治疗2周期:培美曲塞0.9g静滴d1+卡铂500mg静滴d1+贝伐珠单抗600mg静滴d1,Q3W。两次化疗加抗血管治疗后2023-09-13胸部CT示(图5):两肺转移瘤增多、增大。疗效评价:PD。患者在接受化疗之后,体力情况下降,S-2,右侧锁骨上淋巴结仍肿大,大小质地同前。2023-09-15对锁骨上淋巴结穿刺活检组织行PD-L1表达(2C3抗体)检测,示:TPS=80%。
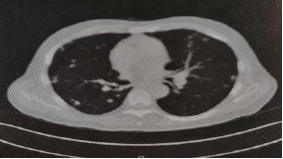
图7.2023-09-13胸部CT可见肺内多发转移瘤
第五次MDT讨论:患者肿瘤经系统化疗再次进展,下一步如何治疗。
病理科:将肺癌的PD-L1免疫组化应用TPS进行评估。TPS应对切片内所有的肿瘤细胞进行阳性率评估,阳性的肿瘤细胞应表现为线性的、可靠的细胞膜着色(胞浆可着色,可不着色)。其余的细胞,主要是炎症细胞和肿瘤间质细胞、血管内皮细胞等,即使为阳性,也不能被记入阳性细胞。因此,对于肺癌PD-L1阳性率的评估,除了对免疫组化片进行定量计数外,同时应结合HE形态,对无效细胞进行甄别。本例的肿瘤细胞着色清晰而明显,背景上的炎症细胞以及间质细胞基本为阴性,干扰较弱。本例的肿瘤细胞PD-L1的阳性率较高(>50%,应被当做PD-L1高表达的病例,患者后期在免疫治疗中获益的可能性较高。
肿瘤内科:化疗联合抗血管治疗的疗效不佳,并且出现了体力评分的下降,淋巴结穿刺PD-L1(22C3)提示患者属于免疫高表达人群。EGFR基因是免疫单药治疗的负性因子,免疫治疗的疗效不佳,但考虑该患者有EGFR耐药突变,目前这类患者能进行免疫治疗的获益数据并不多。在2018年,免疫PD-1药物已经在国内上市,考虑患者有多线化疗耐药,结合PD-L1TPS≥50%,可考虑免疫治疗。
治疗情况2023-09-28开始予以帕博利珠单抗200mg静滴Q3W治疗。用药后,患者的体力状况逐渐得到改善,PS=0。定期进行复查,胸部CT提示双肺结节及淋巴结未见增大。疗效评价SD。无不良反应。根据随访,患者于2024年10月死于非肿瘤事件。
总结
该患者是一例EGFR Exa20ims突变患者。这是EGFR-TKI耐药突变,但同时该患者有PD-L1免疫高表达。既往的研究均显示EGFR敏感突变患者的PD-1/-PD-L1抑制剂的疗效不佳且易出现超进展,因此,大多数的免疫药物研究中均排除了EGFR敏感突变的人群,仅IMPOWER150研究中显示EGFR/ALK突变患者在化疗联合贝伐珠单抗和免疫的四药联合方案中有获益,但大部分也是TKI耐药后的患者。但临床中有部分为EGFR耐药突变的患者,如EGFR Ex2Ois,这部分人群的靶向治疗的疗效有限,免疫治疗是否有获益也是值得探索的。所以,对于携带EGFR Exz20ins的患者,由于其较高的PD-L1表达,这部分患者可能从兔疫治疗中获益,但仍需更多的研究数据来证实。
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





