本例患者为青年女性,晚期胃癌伴双侧卵巢转移,经过有效的系统化疗后,成功进行卵巢切除及原发灶切除的综合治疗,患者总生存期超过3年。针对晚期肿瘤患者需要综合评估,个体化治疗才能带来长久生存。
病历资料
患者,女,27岁,2017年开始间断上腹痛,2~3次/周,空腹为著,进食后好转。2018年6月起腹痛发作较前频繁,且出现1次黑便。2019年7月自觉腹围增大,右下腹可触及5cmx5cm质硬包块,活动度差,伴月经期延长、月经周期缩短。胃镜:胃体下段大弯侧可见一巨大溃疡,直径约1.5cm,周边黏膜堤样隆起。病理:胃中-低分化腺癌。糖类抗原125(CA125)742.2U/ml,糖类抗原72-4(CA72-4)570.8U/ml。腹盆增强CT(图1):胃角处胃壁增厚伴异常强化,浆膜面尚光整;下腹及盆腔可见两个巨大囊实性占位,部分强化,右侧9cmx5cmx11c11cm,呈分叶状,左侧13cmx9cmx11cmcm,长椭圆形;腹盆腔大量积液。诊断:胃中-低分化腺癌(cT3N,M1,IV期),淋巴结转移,双侧卵巢转移。既往史、个人史、婚育史、家族史无特殊。体格检查:身高160cm,体重52.5kg,体表面积1.62㎡,ECOG评分1分,双侧下腹部扪及质硬包块,左侧大小约10cmx10cm,右侧大小约9cmx8cx8cm,双下肢不肿。
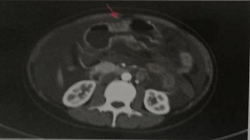
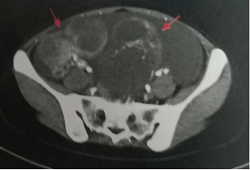
A B
图1 胸腹盆增强CT(2019年7月)
A.化疗前(2019年7月)胸腹盆增强CT示胃壁增厚;B.下腹及盆腔可见两个巨大囊实性占位。
治疗经过
患者于2019年7月14日至10月11日行一线SOX方案化疗5程,具体为:奥沙利铂150mg静脉滴注dl,替吉奥60mg bid口服d1~d14,每3周为1疗程。2、4程后评估为病情稳定(SD)。2014年10月复查CA12579.6U/ml,CA72-4 78U/ml。CT:原胃角处胃壁增厚较前减轻;右心膈角、腹膜后多发淋巴结影,较前减小;原片腹腔大量积液,本次未见;腹盆腔巨大占位性病变,病灶较前增大,但密度及强化较前减低。
2019年10月24日行全子宫及双侧附件切除术+大网膜切除15cmx6cn术,术中探及胃大弯处5cmx2cm实性肿物;右侧卵巢见15cmx6cm实性肿物,左侧卵巢可见10cmx7cm实性肿物;子宫表面光滑,大网膜、肠管未见转移灶。术后病理:双卵巢转移性低分化腺癌。免疫组化:AE1/AE3(+),CK20(+),CK7(+)。
2019年11月18日至2020年1月23日行术后SOX化疗3程,具体为:奥沙利铂150mg静脉滴注dl,替吉奥60mg bid 口服d1~d14,每3周为1疗程。2020年2月9日至6月15日替吉奥单药维持化疗6程。
2020年5月胃镜:胃体下部大弯侧原恶性溃疡已经愈合,成为IIc型病变,病灶底部发白,有结节颗粒感,周边皱襞逐渐变细。活检病理:(胃体)胃黏膜显慢性炎,间质内少许核稍大细胞。2020年7月28日行胃癌切除术(D2)+毕I式吻合术。术中胃体下部大弯侧可及一个大小约2.5cmx1.8cm的肿物,浆膜似光滑;肝脏表面及盆腔未发现肿物。术后病理:胃黏膜显慢性炎,黏膜中、黏膜下及深肌层中见极少许低分化腺癌残留(弥漫性胃癌,消失约98%),符合化疗后改变;断端阴性;未见淋巴结转移;网膜未见特殊;腹腔灌洗液(-)。免疫组化:Her-2(0)。术后继续口服替吉奥维持治疗至2021年2月。
2021年8月查超声:双颈部及锁骨上窝低回声,转移癌不除外。胸腹盆增强CT(图2):腹膜后多发淋巴结,较前明显增大,转移可能;左肾盂及上段输尿管扩张,左侧上段输尿管局部异常增厚软组织密度影,与腹膜后肿大淋巴结分界不清。2021年9月13日至2022年1月14日行SOX方案化疗4程,具体为:奥沙利铂150mg静脉滴注dl,替吉奥60mg早饭后、40mg晚饭后口服d1~d14,每3周为1疗程。2程、4程和6程后病情评估为SD,此后继续替吉奥单药维持治疗至2022年7月。2017年7月19日患者出现发热,体温最高38.5℃,伴胸痛、胸闷,胸腔积液中找到腺癌细胞,考虑疾病进展。患者因感染性休克于2022年8月15日去世,总生存期为37个月。
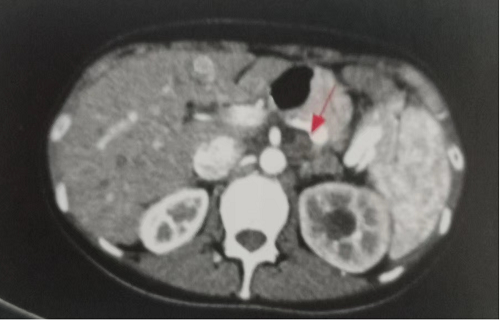
图2 胸腹盆增强CT(2021年8月)
讨论
胃癌卵巢转移概况
本例患者为年轻女性,以盆腔包块起病,经检查确诊为胃癌卵巢转移。对于女性胃癌患者,特别是年轻女性,需警惕卵巢转移的风险。胃癌卵巢转移发生率各家报道不一,为0.8%~6.7%;大多数亚洲数据提示发生率为3.0%~5.0%,以同时性转移多见,但尸检发现的转移率高达30%~40%,我国胃癌病理协作组报道的中国胃癌尸检卵巢转移率达43.6%。胃癌卵巢转移好发于绝经期前女性,平均发病年龄为40~50岁,认为与女性生殖期卵巢生理功能活跃、血运丰富有关。胃癌卵巢转移瘤多表现为双侧;若为单侧,则以右侧多见。卵巢转移常为腹膜弥漫转移的一部分,约50%以上的患者有可能同时合并盆腔、腹腔、腹膜转移。胃癌卵巢转移预后极差,中位生存期仅7~14个月。
胃癌卵巢转移,是否要手术切除卵巢
本例胃癌卵巢转移,一线采用了标准的奥沙利铂联合替吉奥(SOX)方案。目前美国国家综合癌症网络(NCCN)指南及中国临床肿瘤学会(CSCO)指南均对晚期胃癌一线推荐氟尿嘧啶类和铂制剂联合的两药方案,并作为优选推荐;对于个别体能状态好的患者可以考虑两药基础上再联合紫杉类药物。对于卵巢转移,并没有特别的推荐方案。但Brieau等开展的胃癌卵巢转移化疗敏感性的研究显示,化疗对卵巢转移癌的疾病控制率明显低于其他部位转移灶,分别为33.3%和66.7%,表明卵巢转移癌对化疗敏感性减低。
本例患者在一线SOX方案化疗5程后,在原发病灶、淋巴结、腹水均有改善的情况下,出现了卵巢病灶的增大和密度减低。Ganesh等在晚期结直肠癌的研究中发现,对化疗的疗效与其他转移部位的疗效反应不一致,但并不影响卵巢转移府切除术后的无进展生存时间(PFS)和总生存期(OS)。本例患者年轻,一线化疗后全身病情有所改善,但卵巢转移灶出现增大,经过MDT慎重讨论,决定施行了卵巢切除术。
对于胃癌卵巢转移,是否应该行卵巢转移灶的切除手术,目前仍有争议。有观点认为,卵巢转移为晚期,且存在合并腹膜转移风险,不适合手术。但也有研究发现,胃癌卵巢转移行卵巢切除术可以延长患者OS。Yu等回顾性分析了152例胃癌卵巢转移患者,手术联合化疗的总生存期优于单纯化疗组(19.0个月vs11.8个月;P<0.001);异时性卵巢转移患者也得出了相似结论(24.6个月vs14.3个月;P=0.02)。一项来自韩国的研究报道了91例胃癌根治术后出现异时性卵巢转移的患者,结果显示,手术联合化疗组患者的总生存期明显优于单纯化疗组(19个月vs9个月;P=0.002)。因此,对于卵巢转移是否应该手术,建议各医院多学科团队(MDT)共同决策;特别是卵巢转移的手术时机,对于巨大卵巢占位影响患者生活质量,是否应该先手术切除卵巢?对于晚期孤立卵巢转移,患者可否在全身治疗有效的情况下行姑息减瘤手术?这些情况可以根据各医院多学科团队的经验作出选择,对于有经验的团队,手术是可以选择的方式,但要注意患者人群的筛选。
胃癌卵巢转移,是否要切除原发灶
本例在一线化疗后1年,病情改善且稳定后接受了胃癌原发灶的切除手术。对于晚期转移性胃癌,是否可以行胃原发灶的姑息性切除?目前的指南对于大多数进展期胃癌患者,并不推荐进行姑息性胃切除术。姑息性胃切除术仅推荐用于出血、梗阻或穿孔等严重且不能用入性较小的方法治疗的患者。
III期REGATTA研究直接评估了胃切除术在接受系统性化疗的患者中能否带来生存获益的问题。该试验纳入了175例进展期胃癌患者(这些患者均存在一个局限于肝脏、腹膜或主动脉旁淋巴结的不可治愈性因素),并将这些患者随机分配至仅进行化疗组(替吉奥联合顺铂)或胃切除术后进行相同化疗组。中期分析显示,胃切除术并未显著改善总生存期,该研究提前结束。最终分析显示,仅行化疗组和胃切除术加化疗组的2年生存率分别为32%和
25%。此外,接受胃切除术的患者中化疗相关的严重不良反应发生率明显提高。姑息性胃切除术并未给这些患者带来生存获益。
但也有数项回顾性研究和小型前瞻性研究表明,姑息性胃切除术可能带来生存获益。Peng等研究发现,行原发灶和卵巢转移灶切除可延长患者的生存时间,25例同期行胃和卵巢转移灶切除患者的中位生存期为21个月,而44例仅行转移灶切除患者的中位生存期仅为9个月。虽然REGATTA研究是阴性结果,但也有研究者提出,是否应该对这类患者先进行全身治疗,对于化疗有效的患者再考虑原发灶和/或孤立转移灶的切除,这种治疗策略的研究目前正在开展。
结语
本例青年女性,晚期胃癌伴卵巢转移,经过有效的系统化疗、卵巢切除及原发灶切除的综合治疗,总生存期超过3年。对于卵巢转移的晚期胃癌,全身系统治疗仍是最根本的治疗手段;对于治疗有效的患者,在适当的时机可以考虑卵巢切除、胃原发灶切除。胃原发灶和卵巢转移灶的切除对部分患者可能会带来生存的获益,但切除的时机和患者的筛选需要有经验的多学科团队医生共同决策。
参考文献
[1]FENG Q,PEIW,ZHENG ZX,et al.Clinicopathologic characteristics and prognostic factors of 63 gastriccancer patients with metachronous ovarian metastasis [J]. Cancer Biol Med, 2013,10(2):86-91.
[2]BRIEAU B,ROUSSEL H,MARKOUTSAKIT,et al. Chemosensitivity inovarian metastases from gastriccancer:a case series [J]. Clin Res Hepatol Gastroenterol, 2013,37(3):289-295.
[3]GANESH K, SHAHRH, VAKIANIE,et al.Clinical and genetic determinants of ovarian metastases fromcolorectal cancer. Cancer,2017,123(7):1134-1143.
[4]YUP,HUANG L,CHENG G, et al. Treatment strategy and prognostic factors for Krukenberg tumors ofgastric origin: report of a 10-year single-center experience from China [J]. Oncotarget,2017,8(47):82558-82570.
[5]CHO JH,LIM JY,CHOI AR,et al. Comparison of surgery pluschemotherapy and palliative chemether-apy alone for advanced gastric caner with Krukenberg tumor [J]. Cancer Res Treat,2015,47(4):697-705.
[6]FUJTANI K.YANG HK,MIZUSAWA J,et al. Gastrectomy plus chemotherapy versus chemotherapsalone for advanced gastric cancer with a single non-curable factor (REGATTA):a phase 3,randomisedcontrolled trial. Lancet Oncol. 2016,17(3):309-318.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





