摘要
冠状动脉壁内血肿(IMCH)是急性心肌梗死(MI)的罕见原因。文章目的是回顾当前的知识,并分享我们对因外伤性IMCH导致急性ST段抬高MI的患者的诊断和管理经验。
案例展示
患者是一名67岁的男性,胸痛(CP)演变为9小时。四天前,他发生了一场机动车事故,他以56km/小时的速度撞上一辆汽车,导致胸部钝器外伤(BCT),随后被从摩托车上推了下来。在外部机构进行的评估包括全身计算机断层扫描,显示没有主要器官损伤,他出院时服用曲马多,并指示他休息。
事故发生后,患者自述有胸膜炎样CP,但这种情况正逐渐好转。然而,在就诊前9小时,CP变得持续且强度逐渐恶化,促使患者寻求医疗救助。
到达我们的急诊室后,他的血液动力学稳定(血压137/85mmHg,心率88次/分钟),无发热(36.9℃),并且没有缺氧(氧饱和度97%)。患者的胸壁有各种瘀斑,触诊有压痛,但这种痛与把他带到急诊室的痛略有差异。患者的肺正常,没有检测到心脏杂音。患者的四肢温暖,脉搏对称,没有水肿。
既往病史:
病史与高血压、血脂异常和2型糖尿病有关。患者不饮酒,不吸烟。
检查:
ECG显示V2至V5导联ST段抬高(>1.5mm),Q波提示广泛的前外侧ST段抬高心肌梗死(STEMI)(图1)。高敏肌钙蛋白呈上升趋势(1,844至1,969ng/l),同时B型钠尿肽原(1,168pg/ml)和D-二聚体(8.95μg/ml)升高。床边超声心动图显示心尖前壁运动功能减退,无心包积液。常规实验室检查和胸部X光检查无异常(图2)。
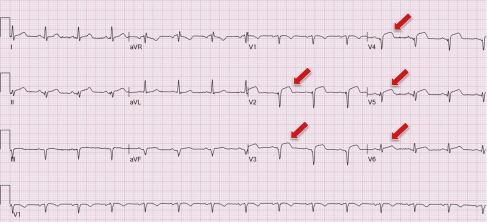
图1:初始心电图。初始心电图显示窦性心律V2至V6导联ST段抬高(红色箭头)以及相关的Q波,提示前外侧ST段抬高心肌梗死。
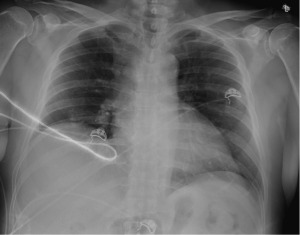
图2:胸部X光。胸片无急性心肺疾病,无明显骨折。
鉴别诊断
BCT后与ST段抬高相关的CP与动脉粥样硬化血栓形成相关的心肌梗死(MI)、主动脉夹层、心脏挫伤或冠状动脉夹层/壁内冠状动脉血肿(IMCH)有关。
管理
BCT后,从外伤或缺血中辨别CP并确定疑似STEMI的发作可能具有挑战性。此外,抗凝剂/抗血小板剂可能会导致内出血。然而,根据与急性STEMI一致的新持续CP和ECG变化的估计持续时间9小时,建议进行急诊冠状动脉造影。给予负荷剂量的双重抗血小板治疗(DAPT)和静脉注射肝素。冠状动脉造影显示左前降支中段(LAD)次全闭塞,心肌梗死(TIMI)血流缓慢溶栓1级(图3A)。将导丝自由推进到顶端LAD段后,没有顺行血流提示通过双腔导管远端注射确认腔内位置,之后进行抽吸血栓切除术和冠状动脉内硝酸甘油给药。血管造影随后显示在出现动脉粥样硬化血栓形成的罪魁祸首病变远端有一段持续的长管腔狭窄,轮廓光滑,这引起了对与近期BCT相关的外源性冠状动脉压迫的怀疑(图3B)。血管内超声(IVUS)证实存在广泛的壁内血肿并伴有管腔受损(图4)。
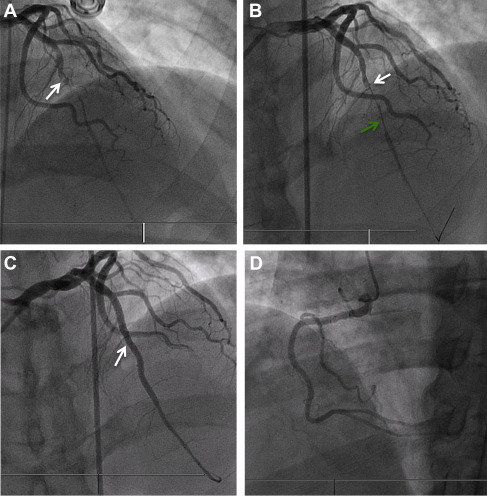
图3:冠状动脉造影
(A)左前降支中段次全闭塞,心肌梗死血流1级溶栓和提示血栓的充盈缺损(白色箭头)。(B)在对左前降支中段(白色箭头)进行抽吸血栓切除术并提供200μg冠状动脉内硝酸甘油后,长而光滑的管状病变持续存在(绿色箭头),考虑到最近的钝性血栓病史,引起了对外部压迫胸壁的怀疑。(C)最终结果左前降支中段血管内超声引导支架置入术后(白色箭头)。(D)正常右冠状动脉。
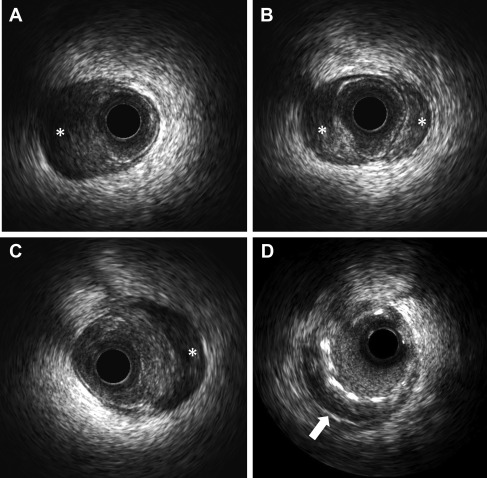
图4:血管内超声
(A至C)血管内超声帧显示左前降支中段至远端广泛的螺旋壁内血肿(*)并伴有管腔受损。(D)左前降支中段血管内超声引导支架置入术后,伴有残余壁内血肿(箭头)。
使用2.75mm×38mm药物洗脱支架进行IVUS引导的直接支架置入术,小心地将远端支架边缘放置在IMCH的远端,然后向近端部署3.0mm×16mm药物洗脱支架重叠最小。TIMI流量等级3随着症状的消退和ST段变化的改善而恢复(图3C和4D)。升主动脉造影未见夹层或动脉瘤(图5C)。
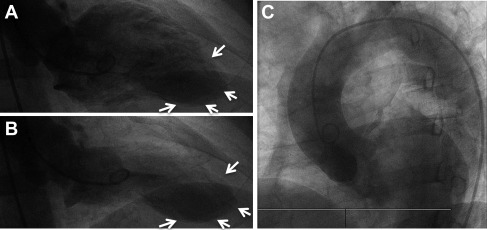
图5。心室和主动脉造影
心室舒张(A)和收缩(B)帧具有远端心尖下和前心尖运动减退(白色箭头)的证据,对应于环绕的左前降支动脉区域和轻度降低的整体收缩功能(射血分数40%至45%)。(C)无夹层或动脉瘤证据的升主动脉造影
讨论
IMCH是冠状动脉夹层的一个子集,当血液因内膜撕裂或滋养管破裂导致管腔狭窄而积聚在中膜时,会发生冠状动脉夹层,这会导致MI、心律失常、心源性休克和心源性猝死。
自发性或创伤相关的IMCH是一种罕见、认识不足且具有挑战性的诊断,占所有MI的1%至4%。它更常见于6.7%的经皮冠状动脉介入治疗(PCI)病例中的医源性并发症。虽然几乎没有报道,但在机动车事故和接触性运动后已有描述。
当BCT后不久出现急性冠状动脉综合征时,应考虑创伤性冠状动脉夹层/IMCH的可能性,并应考虑早期冠状动脉造影。尽管血管造影显示轮廓光滑的长病变可能会像我们的病例一样怀疑IMCH的外源性压迫,但仍需要冠状动脉内成像来确诊并与螺旋冠状动脉夹层或动脉粥样硬化血栓形成区分开来。
在对自发性或外伤性冠状动脉夹层或IMCH做出解剖学诊断后,操作者必须决定是否需要立即血运重建。与建议早期血运重建的动脉粥样硬化血栓形成相关的心梗相反,自发性冠状动脉夹层(SCAD)的回顾性研究似乎仅在存在持续/复发性缺血、血流动力学不稳定、TIMI血流分级0至1等高风险特征时才支持血运重建,或存在持续性室性心律失常。PCI仍然是优于手术的首选血运重建策略,除非是在无保护的左主干或近端2支血管SCAD的情况下。尽管如此,如果存在血肿的轴向延伸或医源性夹层或假腔的无意支架置入术,PCI可能会导致IMCH/夹层患者的预后更差。因此,冠状动脉内成像是强制性的,以确保腔内位置和IMCH延伸的充分覆盖,并仔细注意支架的定位和尺寸。根据美国心脏病学会/美国心脏协会指南,PCI后应提供长期DAPT。
相反,对于没有高危特征的稳定型SCAD患者,建议采用保守方法,在1个月时进行复查血管造影以评估愈合情况。一项针对631名非随机SCAD患者的荟萃分析表明,就死亡率、MI和复发性SCAD而言,血运重建与药物治疗之间没有显着的统计学差异。罗戈夫斯基等人。在30名患者中的29名(97%)患者中,经过1个月的保守治疗后,SCAD的血管造影解决方案在中位随访4.5年后的生存率为100%。回顾性研究似乎倾向于对没有高危特征的稳定型SCAD患者进行初始保守治疗,而不是早期血运重建,这可能外推到那些有外伤性IMCH相关MI的患者,因为没有公布比较治疗结果的大型系列研究
关于药物治疗,长期DAPT对未接受PCI的患者的益处尚不明确;然而,有些人推荐短期DAPT疗程(1至3个月),而另一些人只推荐阿司匹林至少1年。延长DAPT的适用性应基于个体出血风险因素。此外,如果存在高血压或收缩功能障碍,则应与神经激素阻断剂一起提供β受体阻滞剂。
跟进
我们的患者没有出血事件,也没有MI引起的电气或机械并发症。MI后第1天的超声心动图(图6)显示射血分数为40%至45%。他在MI后第5天出院回家,接受了指南指导的药物治疗。血运重建后三个月,他的射血分数为45%至50%,并且没有心绞痛。
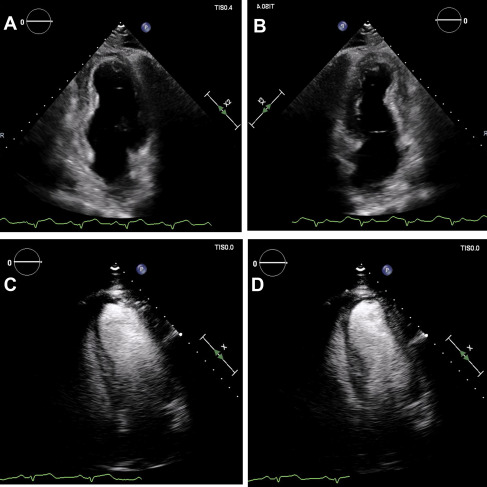
图6。心肌梗死后第1天的经胸超声心动图
双腔舒张(A)和收缩(B)帧显示前尖壁、下尖壁和前间隔壁中部严重运动减退。四腔舒张(C)和收缩(D)帧与静脉造影显示间隔和侧尖壁的严重运动减退。没有左心室血栓、心包积液或主要瓣膜病的证据。
结论
IMCH是一种罕见且可能未被充分认识的MI原因。当遇到急性STEMI患者时,询问BCT病史是合理的。在该临床背景下,使用冠状动脉内成像用以评估病变可能是可取的。在存在持续缺血和需要立即血运重建的情况下,冠状动脉内成像可以帮助指导经皮介入治疗。
参考文献
[1] Lempereur, A. Fung, J. Saw.Stent mal-apposition with resorption of intramural hematoma with spontaneous coronary artery dissection
Cardiovasc Diagn Ther, 5 (2015), pp. 323-329
[2] Rogowski, M.T. Maeder, D. Weilenmann, et al.Spontaneous coronary artery dissection: angiographic follow-up and long-term clinical outcome in a predominantly medically treated population.Catheter Cardiovasc Interv, 89 (2017), pp. 59-68
[3] Martins, V. Afreixo, L. Santos, et al.Medical treatment or revascularization as the best approach for spontaneous coronary artery dissection: a systematic review and meta-analysis
Eur Heart J Acute Cardiovasc Care, 7 (2018), pp. 614-623
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。