随着免疫疗法的不断发展,转移性透明细胞肾细胞癌(mccRCC)患者的治疗前景得到了迅速的拓展,其中包括单独或联合使用免疫治疗以及使用抗血管生成药物等多种治疗策略。对于患有不耐受或肿瘤进一步恶化的病人,首选治疗方案为联合αPD-1和αCTLA-4以及αPD-1+酪氨酸激酶抑制剂(TKI)。由于其不良反应发生率低,且具有良好的耐受性,已成为目前治疗肾移植术后转移性病变的主要选择之一。然而,在实际的治疗过程中,我们发现盲目的药物使用策略会增加治疗暴露的风险和相关毒性,因此迫切需要寻找这类患者的配对生物标志物。这些生物标志物能够协助实现患者与最具潜在临床益处的方案的精准匹配。本文总结了目前针对不同疾病类型、药物剂量及疗程选择时进行配对研究的现状及其意义,并对其存在问题提出相应建议。在理想情况下,这样的配对能够最大程度地减少不必要的治疗暴露和相关毒性,从而提高治疗效果。
1.TIL浸润与生存期正相关但与坏死评分无关
在作者的评估下,我们纳入了136个符合标准的肿瘤样本,并对患者的肿瘤内免疫细胞浸润情况以及肿瘤内部坏死情况进行了全面的评分。接着,作者对这些患者的TIL浸润情况以及肿瘤坏死情况进行了分析,并探讨了它们与治疗效果之间的相关性。
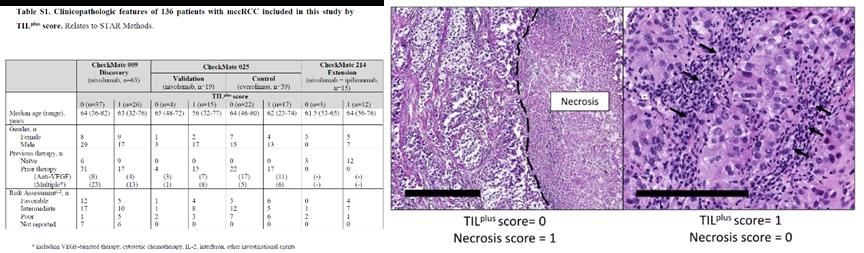
根据作者的研究,TIL评分的高低与患者的生存期呈现出显著的正相关性。相较于TILplus评分为0的样本,TILplus评分为1的样本在总生存期方面呈现出显著的延长趋势。因此认为,对于有一定程度淋巴结转移或复发风险的肺癌病人应考虑使用免疫抑制药物来降低其发生远处转移性疾病的危险性。经过深入分析,作者发现,接受αPD-1疗法的TIL浸润程度较高的患者,其生存期(OS)显著延长,中位生存期为40月,而vs.4.4月。另外,本文还对β受体阻滞剂、非特异性抗癌药、糖皮质激素及联合应用上述药物进行研究以评估其疗效。尽管样本数量有限,然而在接受αPD-1+αCTLA4治疗的患者中,我们仍然观察到了相似的趋势。这些研究结果显示,选择性的激酶抑制剂可以显着降低晚期非霍奇金淋巴瘤患者的生存率,改善临床结局。需要注意的是,在接受选择性激酶抑制剂依维莫司(Everolimus)治疗的患者(对照组)中,TIL的浸润水平与患者的生存期或客观反应之间并不存在显著的相关性,因为依维莫司直接且持续作用于mTOR靶点,从而发挥出三重抗肿瘤作用,有效地抑制了肿瘤细胞的生长与增殖、营养代谢以及血管生成因子的生成和释放。因此,对于那些没有发生明显并发症的晚期癌症患者来说,其生存质量可能更依赖于药物的疗效及其对正常组织损伤程度。仅有那些接受特定免疫检查点抑制剂(ICB)治疗的患者才会呈现出此结果。
那么,是否存在一种与患者生存期相关的因素,即肿瘤内坏死的特征?如果有这种情况存在,为什么不将其作为治疗策略考虑呢?否定的答案已经浮现!肿瘤中的坏死主要发生在正常组织或间质细胞周围以及血管内皮细胞和平滑肌等结构层次中。然而,TIL浸润所带来的益处受到了肿瘤坏死区域的一定程度的干扰。在TIL浸润评分相同的情况下,患有肿瘤坏死的病人的生存期往往不如那些缺乏坏死区域的病人。
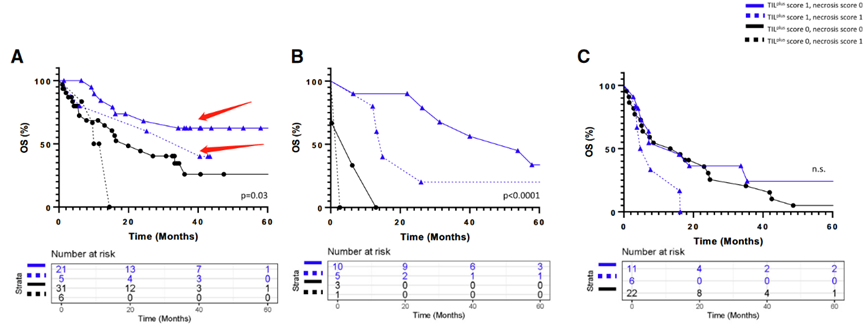
2.PBRM1功能缺失突变TIL浸润分数和肿瘤坏死分数三者结合可更好的预测OS和αPD-1治疗
PBRM1基因的突变导致免疫相关基因表达特征的增加,同时也与CD8T细胞的浸润有关。作为αPD-1免疫检查点抑制剂的靶细胞,CD8T细胞的浸润程度与αPD-1疗法的疗效呈正相关。因此,在本研究中我们对参与该过程的两个不同亚群进行了比较分析,以了解其临床意义及可能机制。在纳入统计的患者中,约有48.5%(47/97)出现了PBRM1功能丧失突变,这些患者的基线特征与队列中的其他患者无显著差异。在该亚群中,PBRM1的突变状态(包括突变型和野生型)与操作系统存在密切关联。因此我们认为,通过对该亚群人群进行早期基因筛查可以发现更多具有潜在临床意义的基因突变类型并指导其后续的临床诊治工作。此外,作者未发现PBRM1基因是否发生突变与TIL浸润评分之间存在任何相关性,这一结论在这些样本中得到了验证。因此,我们认为该研究未能对临床上出现的这种变异做出正确解释。在本文中,作者深入探讨了αPD-1治疗后OS与TIL浸润、肿瘤坏死以及PBRM1突变之间的关联,以提高OS的预测准确性。在TIL评分为1,的情况下,那些存在PBRM1,突变的患者的OS长度被判定为最长,而其坏死评则为0。患有三个特征中的两个特征的病人表现出中等生存期,而仅有三个特征之一的病人则呈现出最低的生存率。此外,我们还讨论了不同类型病人在处理策略上的差异。通过将H&E评分与PBRM1突变状态相结合,作者发现,在比较具有三个特征的患者和仅存在一个特征的患者时,风险比(Hazard ratio,主要用于生存分析)得到了改善,这相当于考虑了生存时间和控制因素对事件结果发生情况的影响程度。
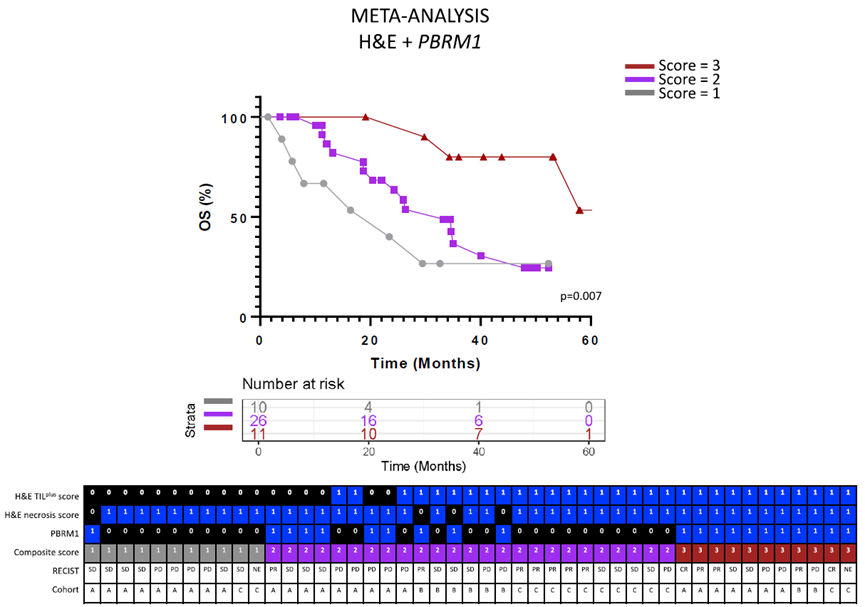
实验结果表明,采用组合生物标志物的方法,相较于单独使用H&E评分或PBRM1突变状态,具有更好的效果。这可能是因为在这些病例中有一些基因位点是通过改变其功能而发生异常变化,从而导致了对该疾病产生特异性诊断和鉴别诊断能力降低。治疗的客观反应与组合评分密切相关(p=0.04),据作者观察,该相关性不仅限于接受αPD-1治疗的患者。
最终呈现,通过检索38种相关预测出版物,作者运用多模态生物标志物方法,对αPD-1治疗后的患者预后进行了预测。这些出版物未开发基于H&E的预测手段,仅将H&E染色作为表征手段,这进一步凸显了在αPD-1疗法的生物标志物发现中,基于H&E的分析结果未得到充分利用的事实。
总结
H&E染色在肿瘤治疗中被广泛应用于评估根治性切除标本中新辅助治疗的病理反应,以及检测晚期不可切除患者的治疗效果,从而为肿瘤治疗提供了有力的支持。根据作者的研究,在免疫治疗的背景下,通过对肿瘤TIL浸润、坏死和相关基因突变的H&E染色分析,可预测接受抗PD-1治疗的患者的“响应率”。此外还可以利用这些信息来指导个体化的选择化疗方案及给药剂量以降低不良反应发生率。研究表明,针对mccRCC患者,采用组合生物标志物(包括H&E发现和PBRM1突变状态)可实现更进一步的分层效应,其中TIL浸润程度高、肿瘤坏死评分低,且PBRM1突变的患者生存期最长。同时作者也提出,对于不同类型的疾病应采取相应的处理措施以最大限度地保护正常组织及器官。通过作者的方法,可以对αPD-1单药治疗可能产生反应的患者进行鉴别和筛选,从而避免不必要的第二种药物暴露,减少不必要的药物损伤,并提高在采用相应治疗方案时的风险-收益比。
参考文献:
【1】Deutsch JS, Lipson EJ, Danilova L, Topalian SL, Jedrych J, Baraban E, Ged Y, Singla N, Choueiri TK, Gupta S et al: Combinatorial biomarker for predicting outcomes to anti-PD-1 therapy in patients with metastatic clear cell renal cell carcinoma. Cell reports Medicine 2023, 4(2):100947.
【2】 Dong Y, Sun Q, Zhang X: PD-1 and its ligands are important immune checkpoints in cancer. Oncotarget2017, 8(2):2171-2186.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。