基本病史
患者,女性,71岁,因“咳嗽、喘憋1周,发现右肺占位3天”于2020年9月24日入住肿瘤科。2020年9月17日患者在无明显诱因下出现间断咳嗽,干咳为主,活动耐量较前下降,走200米即出现喘憋。行X线胸片检查提示“右肺门高密度影”。患2型糖尿病,口服降糖药,血糖控制稳定;冠心病病史5年,曾行经皮冠状动脉介入治疗(PCI)。目前无胸闷、胸痛发作。吸烟40余年,约10支/天
入院检查
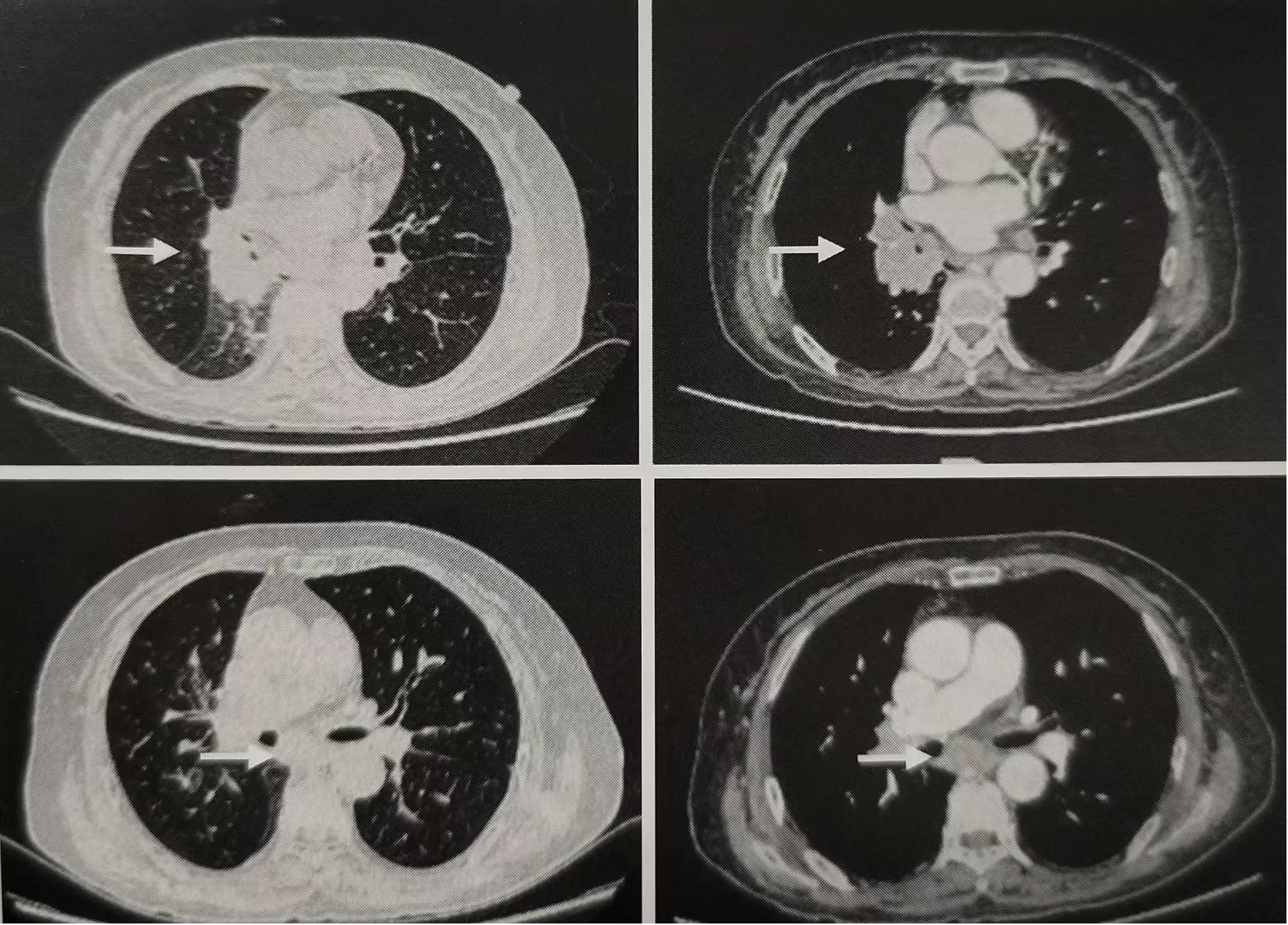
入院后行血常规、肝功能、肾功能、电解质、空腹血糖等检测,均基本正常;ProGRP420.44ng/L,神经元特异性烯醇化酶(NSE)93.45ug/L;2020年9月26日胸部CT检查示(图1):右肺下叶脊柱旁软组织影,考虑右下肺中央型肺癌,伴右下肺不张改变;右肺门及纵隔内多发性肿大淋巴结。2020年9月27日支气管镜检查示:右肺上叶开口清晰:右肺中叶开口轻度肿胀、尚光滑;右肺下叶开口充血,外压饱满,背段开口浸润样闭塞,咬取活检质脆、易出血:左肺支气管树黏膜光滑,各叶段开口清晰,未见明确异常。病理诊断:(右肺下叶咬取活检)小细胞癌,Ki-67(90%+),CK(+), TTF1(+),Syn(+), CgA(+), CD56(+)。2020年9月30日PET/CT检查示:右肺下叶背段支气管闭塞伴软组织肿块(约5.5cm×3.2cm,SUV值8.6);纵隔内气管右后、腔静脉周围、主肺窗、隆突下及右肺门多发性结节及肿块;第4胸椎、第1腰椎、右侧髂骨及骶骨骨密度欠均,PET显像可见放射性浓聚,考虑骨转移。
治疗经过
患者目前诊断:右肺下叶小细胞癌广泛期(ES-SCLC);冠心病PCI术后,心功能Ⅱ级(NYHA);2型糖尿病。
2020年10月9日起给予度伐利尤单抗1500mgd1+依托泊苷148mgd1-3+卡铂300mgd1,4周期;12月17日起胸部调强放疗45Gy/15次,其后度伐利尤单抗1500mgd1+依托泊苷148mgd1-3+卡铂300mgd1,1周期;随后度伐利尤单抗1500mg,维持4周期。
2021年2月疗效评价近临床完全缓解(nCR)。治疗期间先后出现免疫相关性肺炎、放射性肺炎和放射性食管炎,给予积极对症处理后明显改善。
2021年12月随访PET/CT见右肺中叶局部复发,予以依托泊苷148mgd1-3+卡铂300mgd1,4周期化疗后病灶再次CR。其后患者规律复查CT及骨扫描,病情稳定,但时有吞咽困难,内镜显示食管中度狭窄,考虑与放疗相关。
2022年5月行内镜下综合治疗后管腔通畅,患者吞咽困难明显改善。后规律复查随访,
2023年5月复查PET/CT示病灶稳定,接近CR。
末次随访为2024年10月20日,患者于2024年10月20日复查PET/CT提示第2、3胸椎周围软组织影,考虑骨转移,相应水平脊髓不除外受累,正在进行局部放疗。患者的OS>48个月。
临床特征归纳
(1)患者,女性,71岁,因“咳嗽、喘憋1周,发现右肺占位3天”就诊。既往有长期吸烟史。
(2)胸部CT检查发现右肺下叶中央型肺癌,伴右肺门及纵隔淋巴结转移。病理确诊ES-SCLC。
(3)4周期度伐利尤单抗十依托泊苷十卡铂(CE方案)治疗,联合胸部调强放疗,最佳疗效PR;其后免疫单药维持4周期,疗效nCR;半年后局部复发,PFS14个月。重启CE方案4周期后病灶消失,病情持续缓解,PS32个月。OS>48个月。
(4)治疗期间先后出现免疫相关性肺炎、放射性肺炎和放射性食管炎,经对症处理后明显改善。
治疗过程讨论
小细胞肺癌(SCLC)是一种难治、预后极差的肺癌亚型,其特征是快速生长和早期扩散,2020年CSC0肺癌指南标准线方案为铂类联合依托泊苷,PFS<6个月,0S 8-10个月,如何延长SCLC患者的生存期,是肿瘤科医生面临的挑战。
一线选择免疫联合化疗
本例患者2020年9月确诊ES-SCLC,在当时免疫联合化疗方案刚进入NCCN指南一线治疗,而PD-LI抑制剂阿替利珠单抗在我国尚未上市,患者及家属积极治疗的意愿非常强烈,结合当时CASPIAN研究结果[1],与家属充分沟通后,最后给予度伐利尤单抗+依托泊苷+卡铂治疗。鉴于患者年龄大,体质偏弱,合并骨转移,骨髓功能较差,AUC取4,给予“度伐利尤单抗1500mgd1+依托泊苷148mgd1-3+卡铂300mgd1”方案。首次治疗后患者咳嗽、喘憋缓解,2周期后影像学评价疗效显著,右肺门及纵隔肿块明显缩小,接近CR。
放疗联合免疫协同增效
2020年指南推荐,针对ES-SCLC患者,在疗效判定CR或PR时,加用胸部放疗可降低局部复发风险[2],然而这种放疗指南推荐是基于免疫治疗前时代,免疫治疗加入后的可行性及安全性有待探索。考虑到放疗联合免疫治疗可能有协同促进作用[3,4],能够提高局部和全身控制率,获得更长生存,降低复发风险,且该联合的相关损伤风险均在可控范围,结合患者意愿,我们最后采取了夹心疗法(在第3周期治疗结束,加入胸部调强放疗45Gy),同时考虑到免疫治疗联合放疗的潜在风险,在放疗前后1个月,暂停全身洽疗。治疗过程顺利,患者经过4周期同步放疗、化疗和免疫治疗后病灶稳定,后续继续给予4周期免疫单药维持后,患者出现3级放射性肺炎和2级放射性食管炎,但均在临床可控范围,给予对症支持治疗后症状好转。因考虑免疫相关性肺炎再燃风险,暂停免疫治疗。
患者半年后局部复发,重启CE方案,4周期后病灶消失。2023年5月复查PET/CT病灶接近CR。另外,对放射性食管炎进行了内镜下综合治疗,患者的生活质量也得到明显改善,PFS长达32个月。从发病到末次随访,患者已经获得了超过4年的长生存,对于ES-SCLC患者来说,这是一个值得欣喜的结果。
总结
我们认为,早期的免疫联合治疗在这位患者中起到关键作用,同时局部放疗的适时介入,也在患者生存上有明显助力。当然不可否认的是,放疗的介入可能增加放射性损伤风险,在免疫治疗时代,这个问题也会越来越普遍。在本病例中,患者放疗的时机比较激进,后续出现的放射性肺炎及食管炎,是否与放疗联合免疫治疗相关,需持谨慎态度。如何选择放疗的介入时机,在延长生存的同时尽可能减少不良反应,也是我们临床重点关注的问题。
参考文献
1.PAZ-ARES L.DVORKIN M.CHEN Y,et al.Durvalumab plusplatinum-etoposide versus platinum-etoposide in first-line treatment ofextensive-stage small-cell lung cancer (CASPIAN):a randomized,controlled,open-label,phase 3 trial.Lancet,2019,394(10212):1929-1939.
2.YEE D.BUTTS C,REIMAN A,et al.Clinical trial of post-chemotherapy consolidation thoracic radiotherapy for extensive-stagesmall cell lung cancer].Radiother Oncol,2012,102(2):234-238.
3.WEICHSELBAUM RR,LIANG H,DENG L,et al.Radiotherapyand immunotherapy:a beneficial liaison [J]?Nat Rev Clin Oncol,2017,14(6):365-379.
4.WANG S J,HAFFTY B.Radiotherapy as a new player in immuno oncology.Cancers (Basel),2018,10(12):515.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。





