肺癌是全球死亡率最高的恶性肿瘤,近年来我国肺癌的发生率存在明显上升趋势。 定期随访与评估是监控病情的重要手段,近期我科收治了1例肺癌患者,疾病进展影像学表现为肺部弥漫性病变,因临床和影像学特征不典型,类似肺部感染或其他疾病而延迟诊断或误诊,从而延误治疗,现对本病例报告如下。
病例资料
患者,男性,66岁,因“间断咳嗽3年余,胸闷伴乏力1月”于2022年7月7日入院。 患者3年余前因咳嗽就诊当地医院,发现两肺占位性病变,就诊于上海某三甲医院行肺组织穿刺活检明确诊断为肺恶性肿瘤,病理类型为腺癌,分期为T4N2M1a IVa期,驱动基因检测示ALK 基因突变,予以克唑替尼治疗。于2018年12月10日、2019年7月12日行双侧肺癌射频消融术。2020 年12月15日复查胸部CT后,评估为疾病进展,更换药物为阿来替尼抗肿瘤治疗。后定期评估胸部CT示病变稳定(其中2022年3月5日胸部CT见图 1 ~ 4)。 患者1个月前无明显诱因出现胸闷、乏力,2022年6月11日外院复查胸部CT示双肺多发斑片状、结节团块状高密度影,两肺多发小结节,双肺炎性渗出影。有吸烟史800年支。 专科查体:双肺叩诊清音,双肺呼吸音清,未闻及明显干湿性啰音及胸膜摩擦音。
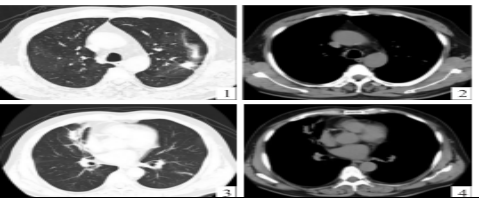
图 1胸部CT 肺窗示左肺上叶团片状实性病变 图2 胸部CT纵隔窗示左肺上叶病灶少许实变影 图3胸部CT肺窗示右肺中叶团片状实性病变,邻近支气管略扩张 图4 胸部CT纵隔窗示病灶实变伴粘连性不张
根据患者胸部影像学表现,分析病变可能的原因有:患者使用靶向药物治疗,先后使用克唑替尼及阿来替尼治疗,是否存在药物相关性肺损伤? 患者病情进展迅速,影像学呈弥漫性病变,病变周围渗出影,是否为感染所致? 一些间质性肺疾病,也可以有类似的影像学表现;此外,患者有肿瘤病史,是否为肿瘤进展所致? 基于以上考虑,因不排除感染性病变可能,立即给予头孢地嗪抗感染治疗。 同时相关检查结果示:血常规:白细胞计数 5. 9×109 / L;C-反应蛋白 9. 24 mg / L↑;肿瘤标志物异常结果:CA125 91. 7 U/ mL↑, CA72-4 17. 8 U/ mL↑;抗核抗体滴度 1:100,pANCA 阴性,cANCA 阴性,抗肾小球基底膜抗体阴性;痰培养阴性;G/ GM 试验阴性。 因肿瘤进展及其他病变不能排除,抗感染治疗期间完善支气管镜检查,送检支气管肺泡灌洗液病原学宏基因二代测序阴性。 于2022年7月14日复查胸部 CT,患者双肺多发的结节状、斑片状高密度影未见明显吸收(见图 5 ~ 8)。
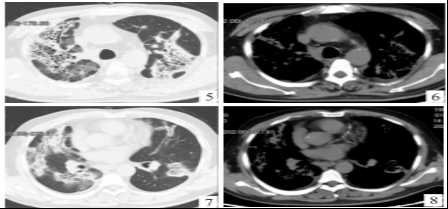
图5 2022 年7月14日胸部CT肺窗示双肺上叶结节状、团块状高密度影,病灶较2022年3月5日胸部CT明显增大 图6 2022年7月14日胸部CT纵隔窗示双肺上叶实变影,双侧胸膜增厚 图7 2022年7月14日胸部CT肺窗示右肺中叶病灶范围较2022年3月5日胸部CT明显增大,双肺下叶新发结节状、团块状高密度影,内部可见多发囊肿空泡及支气管充气征 图8 2022年7月14 日胸部 CT 纵隔窗示双肺广泛渗出实变影,双侧胸膜增厚
于2022年7月17日,右肺上叶前段TBLB病理结果提示为腺癌,免疫组化结果:CK7( + )、TTF-1( + )、NaspsinA( + )、CK5 / 6( - )、P40( - )、P63( - )、Ki - 67( + ,5%) ,见图 9。明确病变性质为肿瘤疾病进展。 患者体能状态评分1分,于2022年7月26日、2022年8月17日给予静脉化学治疗, 治疗方案为: 培美曲塞900mg + 卡铂400mg。 2022年9月8日复查胸部 CT示双肺多发结节状、斑片状高密度影较前明显吸收(见图 10 ~13)。
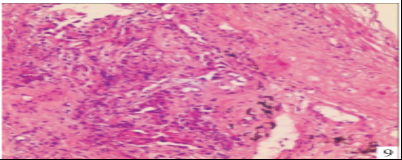
图 9 病理腺癌
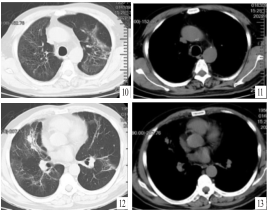
图 10 胸部 CT 肺窗示经 2 个疗程抗肿瘤化学治疗后双肺上叶结节状、团块状高密度影较 2022年7月14 日明显吸收 图11 胸部 CT 纵隔窗示双肺上叶无明显渗出影 图12 胸部 CT 肺窗示右肺中叶及双肺下叶结节状、团块状高密度影较 2022 年 7 月 14 日明显吸收 图13 胸部 CT 纵隔窗示右肺中叶及双肺下叶少许实变影,胸膜无明显增厚,渗出影较 2022 年 7 月 14 日明显减少
讨 论
在中国,肺癌的发病率和死亡率均位于恶性肿瘤中的首位。 非小细胞肺癌疾病进展的影像学多在原发病变基础上增大,实体瘤疗效评价标准 ( RE-CIST)1. 1 版定义的疾病进展:目标疾病进展的总和增加20% ,并且绝对增加5mm,防止在病灶非常小的情况下过度定义疾病进展[1],但本例病情进展患者肺部影像学表现不典型,呈弥漫性病变,评估困难,在诊疗过程中需要与肺部感染性疾病、药物相关性肺损伤、间质性肺疾病等疾病相鉴别,以免误诊。
肺部感染引起肺部变化
其中,肺部感染性病变炎症相关指标常增高,经抗感染治疗后多可完全或部分吸收,本例患者经经验性抗感染治疗后影像学未见好转,相关病原学检测:痰培养阴性、G/ GM 试验阴性、支气管肺泡灌洗液病原学宏基因二代测序阴性,考虑感染的可能性小。 但病原学二代测序存在一定局限性,如对胞内菌及有细胞壁的真菌检测受限,仍需排除部分真菌性肺炎及特殊致病菌感染相鉴别。 同时,由于真菌性肺炎影像学表现多样,可表现为肺炎样改变及弥漫性间质性病变,必要时可以借助血清学实验、真菌抗原和菌体成分检测、病理学检查、镜检及培养等技术进行检测。
药物引起肺部变化
对于非小细胞肺癌Ⅳ期的药物治疗,靶向药物已成为非鳞状细胞肺癌驱动基因阳性且不伴耐药基因突变的一线治疗,根据国内外相关指南推荐[2],本例患者在定期复查评估中发现疾病进展,考虑克唑替尼耐药可能,遂更换药物为阿来替尼治疗。 本例患者更换治疗方案约6 个月后,在评估发现肺弥漫性病变,结合患者用药史,ALK-TKIs 所致的肺损伤成为本例患者鉴别诊断的重点,常与肿瘤进展及其他疾病混淆。 ALK-TKIs 所致的肺损伤在临床报道较少,相关研究显示非小细胞肺癌患者ALK抑制剂相关肺炎发病率的系统回顾及荟萃分析显示其全球发病率低[3]。 国外一项回顾性研究示,7例ALK-TKIs 相关肺损伤患者发生在用药后9天到 531天不等,胸部CT示6名患者表现为机化性肺炎,1名患者为过敏性肺炎[4]。 另一项关于在 117 例克唑替尼相关的间质性肺疾病患者的回顾性研究显示,41. 9% 的患者在服用克唑替尼 4 周内发病, 69. 2%的患者在 8 周内发病,这些患者中 27. 4% 的患者表现为弥漫型肺泡损伤,46. 2% 的患者不伴有弥漫型肺泡损伤表现(其中 9. 3% 表现为肺水肿) [5]。 本例患者最终经病理证实为肿瘤疾病进展。
肺癌弥漫性改变影像学较难鉴别
此病例肺癌疾病进展表现为弥漫型肺癌或肺炎型肺癌,给临床诊断带来挑战,相关研究中提到,通过术后病理确诊的肺癌患者中,只有8. 9%的患者CT 表现为炎症改变,这些患者大多数为腺癌[6]。肺炎型肺腺癌的影像学以斑片状影及磨玻璃影为主,常累及双肺或单侧肺的多个叶段,病变以肺外带及近胸膜下多见,多发性囊性改变和空洞在肺炎型肺癌中也较常见,呈肺炎样改变,极易误诊。相关研究根据病变范围是否大于50% ,对局限性肺炎型肺腺癌与弥漫性肺炎型肺腺癌进行对比研究,结果显示胸膜牵拉在前者中更常见,小叶间裂膨出、空泡征、血管造影征、合并结节、胸腔积液和淋巴结病变在后者更常见,前者最常见的组织学类型为腺泡主导型,而后者为侵袭性粘液腺癌[6]。 由于缺乏特异性表现,尤其是在肺肿瘤评估时出现,常常被误诊为感染性疾病、间质性肺疾病及其他疾病,弥漫型肺癌也可能进展为急性呼吸窘迫综合征,增加诊断挑战性,并可能导致延迟诊断和治疗,如病情允许,建议尽早行病理学检查明确病变性质。
总结
综上所述,在肿瘤治疗过程中,需定期复查胸部影像学改变,肺癌疾病进展胸部影像学表现为弥漫性病变的病例较少见,在诊疗过程中需鉴别诊断,以免延误诊治,如考虑肿瘤疾病进展可能,排除禁忌证后可以完善病理学检查。通过本病例的分享,供临床医师学习,拓展诊疗思路,以提高肺癌的临床诊疗水平。
参考文献
[1]EISENHAUER E A, THERASSE P, BOGAERTS J, et al. Newresponse evaluation criteria in solid tumours: revised RECISTguideline (version 1. 1) [J]. Eur J Cancer, 2009, 45(2): 228- 247.
[2] PENG J M, DU B, QIN H Y, et al. Metagenomic next-generation sequencing for the diagnosis of suspected pneumonia in immuno-compromised patients[J]. J Infect, 2021, 82(4): 22 - 27.
[3] ETTINGER D S, WOOD D E, AISNER D L, et al. NCCN guide-lines insights: non-small cell lung cancer, version 2. 2021[J]. JNatl Compr Canc Netw, 2021, 19(3): 254 - 266.
[4] KOSHIKAWA K, TERADA J, ABE M, et al. Clinical character-istics and risk factors of drug-induced lung injury by ALK tyrosinekinase inhibitors: a single center retrospective analysis[ J]. Tho-rac Cancer, 2020, 11(6): 1495 - 1502.
[5] WANG L, WANG W. Safety and efficacy of anaplastic lymphoma kinase tyrosine kinase inhibitors in non-small cell lung cancer(Review)[J]. Oncol Rep, 2021, 45(1): 13 - 28.
[6]GEMMA A, KUSUMOTO M, KURIHARA Y, et al. Interstitial lung disease onset and its risk factors in Japanese patients with ALK-positive NSCLC after treatment with crizotinib[J]. J Thorac Oncol, 2019, 14(4): 672 - 682.
[7] YANG Y L, XIANG Z J, YANG J H, et al. Effect of alectinib versus crizotinib on progression-free survival, central nervous sys-tem efficacy and adverse events in ALK-positive non-small cell lung cancer: a systematic review and meta-analysis[J]. Ann Pal-liat Med, 2020, 9(4): 1782 - 1796.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。