病例资料
患者,女,52岁,2016-11-16因“体检发现右肺占位5天”入院。当地医院胸部CT示:右肺中叶内侧段类圆形软组织密度影为2.6cmx2.4cm,气管隆嵴前结节影,直径约为0.65cm,提示:①右肺中叶结节,建议增强;②左肺舌段陈旧性病灶;③纵隔淋巴结增大;④肝左叶囊性病灶。2016-11-17本院胸部增强CT示(图1):右中肺可见一大小约为2.5cmx2.1cm的不规则结节影,增强扫描呈不均匀强化,边缘分叶、索条及胸膜牵拉。纵隔4R组增大淋巴结。影像诊断:①右中肺结节,考虑恶性肿瘤;②右肺胸膜下类小结节,考虑良性,建议隔期复查;③纵隔增大淋巴结;④肝小囊肿,胆囊结石;⑤腹膜后散在小淋巴结。2016-11-18支气管及颅脑MRI未见异常。2016-11-20右肺穿刺活检,病理提示:腺癌。
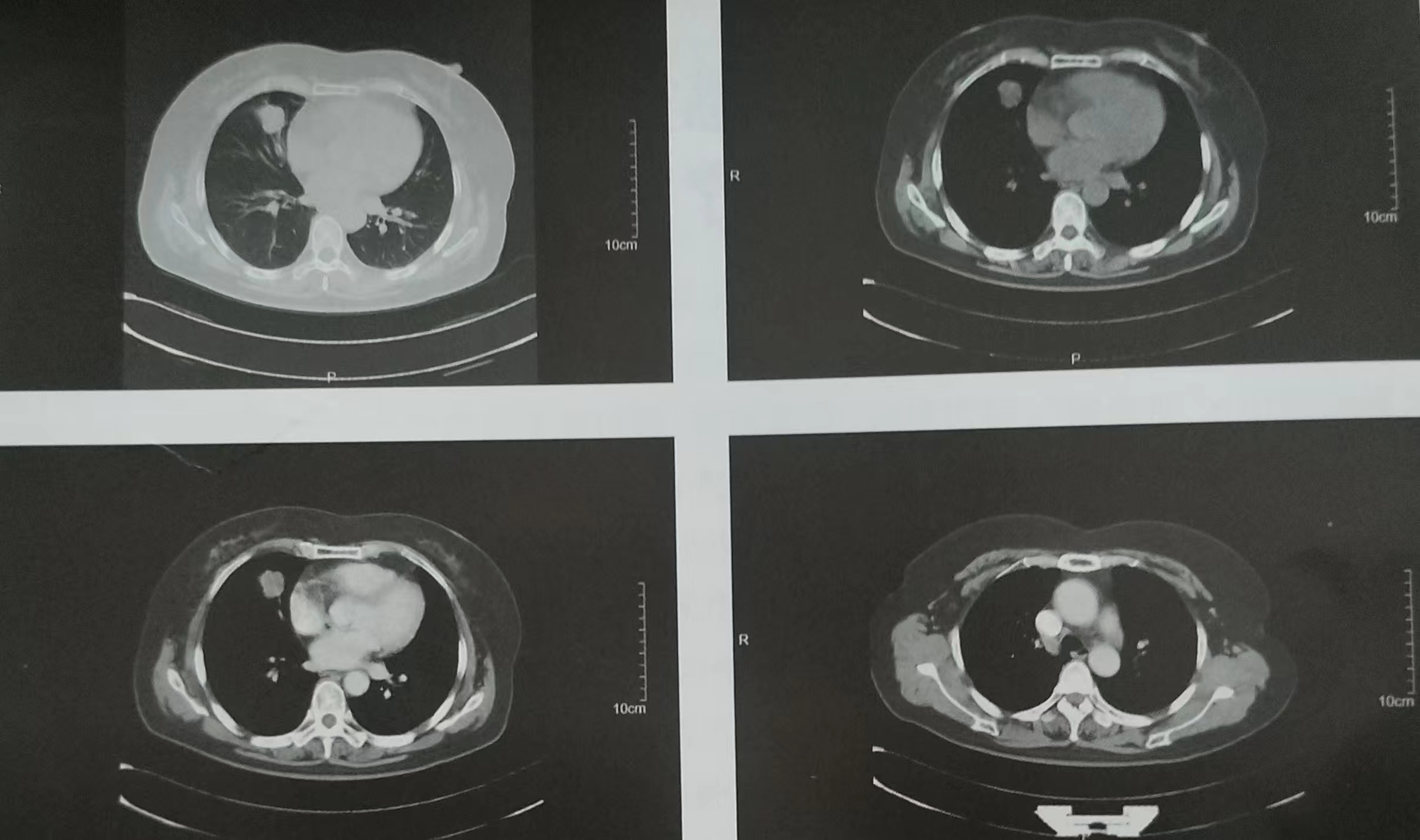
图1 2016-11-17胸部增强CT
初步诊断:右肺中叶腺癌,周围型,cTlbN2M0,IIIA期(AJCC第七版,2009)。
第一次MDT讨论与治疗情况
讨论情况
影像科:右中肺可见一大小约为2.5cmx2.1cm的不规则结节影,内密度欠均,增强扫描呈轻中度不均匀强化,边缘可见分叶、毛刺及胸膜牵拉,局部见血管集束征,边界清晰可辨。纵隔4R组可见增大淋巴结,直径约为1cm,虽然淋巴结的短径小于1cm,但形态偏饱满,增强后结节呈中等度均匀,结合肺内实性病灶,提示有转移风险。影像分期,T1N2aMx。
胸外科:诊断为右中肺腺癌,纵隔4R组淋巴结转移,属于N2-IIIA期。根据NCCN指南,对于IIIA期患者,首先推荐根治性同步放化疗,或者诱导化疗后再进行根治性手术或放疗。但N2淋巴结阳性分多种情况。Robinson分类将N2淋巴结阳性分为四种情况:IIIA1为术前和术中未发现,而术后病理确诊为N2;IIIA2为术中发现N2,但淋巴结转移为单组;IIIA3为术前分期检查为N2,有单组或多组转移,但转移的淋巴结无固定,潜在可完整切除;IIIA4为N2呈巨块状或多组转移表现,转移的淋巴结固定。对于IIIA1和IIIA2的情况,毫无疑问首先进行手术;对于IIIA4的情况,手术无法完全切除,故根治性同步放化疗应该作为首选;目前争议的焦点主要集中在IIIA3,即该患者所处的情况。根据国家卫生健康委员会2018年颁布的《原发性肺癌诊疗规范》,对于N2期单组纵隔淋巴结肿大并且直径<3cm或两组纵隔淋巴结肿大但没有融合,并且预期能完全切除的病例,推荐开展MDT讨论,推荐新辅助化疗+/-放疗+手术,或者手术+化疗+/-放疗的方案。因此,建议该患者首先进行术前新辅助化疗,然后进行手术或根治性同步放化疗。
放疗科:患者为中年女性,肺功能良好,明确为右肺腺癌,纵隔淋巴结可疑转移,建议行EBUS-TBNA检查,明确纵隔肿大淋巴结的性质。若也为腺癌,则属于潜在可切除的右肺NSCLC,建议行新辅助化疗;若退缩明显,能够行根治性手术治疗,则选择右肺中叶切除加系统性淋巴结清扫术;若退缩不明显,无法行R0切除或者R0切除难度大,则可以选择同步放化疗。同步放化疗后若原发病灶及转移淋巴结均可控,可以选择德瓦鲁单抗维持治疗1年。根据INT-0139临床试验的结果,对于T1~3pN2MO的非小细胞肺癌患者,新辅助放化疗(EP方案2周期同步放疗45Gy)后选择手术治疗或者继续放疗至61Gy,两组之间的中位生存时间类似(MST为23.6个月vs22.2个月,P=0.24),5年的生存率上手术组略好于放疗组,但是差异未达到统计学意义(27.2% vs 20.2%,P=0.10),治疗相关死亡率上手术组高于放疗组(7.9% vs 2.1%),放疗组最常见的副反应为中性粒细胞下降和放射性食管炎。
肿瘤内科:患者目前的分期是局部晚期,IIIA期。外科医生首先评估手术的治疗价值,无潜在可切除时可考虑新辅助治疗。如无手术价值,则可行根治性放化疗,后期免疫维持治疗。新辅助治疗可选择免疫联合化疗来提高降期率。
治疗情况
患者强烈要求手术,拒绝行新辅助治疗。患者于2016-12-08在全麻下行胸腔镜下右肺中叶切除术+肺门纵隔淋巴结清扫术,手术顺利。术后常规病理:(右中)肺结节型(瘤体2.6cmx2.5cmx2cm)低分化癌(结合特染及免疫组化,符合低分化腺癌,实性为主型),转移或浸润至(右中肺内支气管旁)0/2只、(第2组)0/2只、(第4组)1/2只、(第7组)0/3只、(第9组)0/1只、(第11组)1/2只淋巴结伴炭末沉着。支气管切缘阴性,未见明显脉管癌栓及神经侵犯。免疫组化:CKK5/6(灶+)、TTF1(-)、P63(个别+)、P40(个别+)、NapsinA(-)、CK7(+)、c-Met(-)、ROS1(-)、Ki-67(+,40%)、CD56(-)、CHG-ACgA(-)、Sy(-)。分子检测:肿瘤样本中检测到EGFR19 缺失突变(弱阳)(ARMS)。
术后分期:右肺中叶腺癌,pT1bN2M0,IIIA期,EGFREx199缺失突变。
第二次MDT讨论与治疗情况
讨论情况
放疗科:患者选择直接手术切除治疗,根据淋巴结站数和个数以及纵隔最高站2组淋巴结阴性的原则,术式基本符合系统性淋巴结的清扫要求,术后病理发现肺门及纵隔4R组存在腺癌转移。虽然有中国医科院肿瘤医院以及欧洲LUNG ART的随机对照研究结果的陆续发表,均表明对于完全切除术后的IIIAN2 NSCLC患者术后进行辅助放疗无法改善总生存情况,但是基于以往的回顾性试验证据,目前的指南仍然推荐对IIIAN2患者进行术后放疗。术后放疗需要在术后化疗完成后进行。2018年JClin Oncol上发表的基于NCDB大型数据库的大样本回顾性试验显示对于R0切除的pN2期NSCLC患者,术后同步放化疗较术后序贯化放疗的生存时间缩短(MST=40.4个月vs58.8个月,P=0.001),因此,目前主张术后辅助治疗顺序为先化疗后放疗。
肿瘤内科:该患者的术后分期为pT1bN2M0,IIIA期,分子检测提示EGFR Ex19 缺失突变(弱阳)(ARMS法)。对于EGFR基因敏感突变的患者,目前的术后辅助治疗可以选择奥希替尼辅助治疗3年或者埃克替尼靶向辅助治疗2年,也是基于ADAURA研究和EVIDENCE研究的结果。2021年,两个靶向药物都相继有NMPA获得的肺癌EGFR敏感突变辅助靶向治疗的适应证。但在2016年肺癌的辅助治疗上还是使用传统的含铂双药化疗4周期。
治疗情况
患者于2017-01-03至2017-03-07予以培美曲塞+顺铂4周期静脉化疗:培美曲塞0.88g静滴d1+顺铂43mg静滴d1~3,Q3W。患者于2017-03-23开始行辅助放疗:右侧肺门及右侧纵隔淋巴引流区P50Gy/25F。2017-04-20复查胸部CT,右肺癌术后化疗后与2017-02-16CT片对比:①右肺术后改变。②右肺胸膜下类小结节,考虑良性,较前相仿;左肺有少许纤维灶。左侧胸膜稍增厚。患者开始进入随访。
患者于2017-09-01因“头晕2周”再次入院。入院查体:神志清,精神软,双瞳孔等大等圆,对光反射存在,肢体力及感觉无特殊,病理征阴性。两肺呼吸音清,未及明显干湿啰音,双侧锁骨上颈部未及肿大淋巴结。2017-09-04颅脑MRI(图2):左侧枕叶及小脑实质内见多发小结节灶,T1WI上呈低信号,T2WI上呈稍高信号,增强后,强化较明显;较大者的直径约为2.2cm,边缘见小片状水肿影;各脑室、脑池和脑沟形态无殊,中线结构无移位。颅骨无殊。提示:左侧枕叶及小脑实质多发转移性肿瘤。胸部+腹部增强CT、全身骨显像、颈部+锁骨上超声等检查均未见明显异常。
目前诊断:右肺腺癌术后,脑多发转移,rT0N0M1,IVB期。
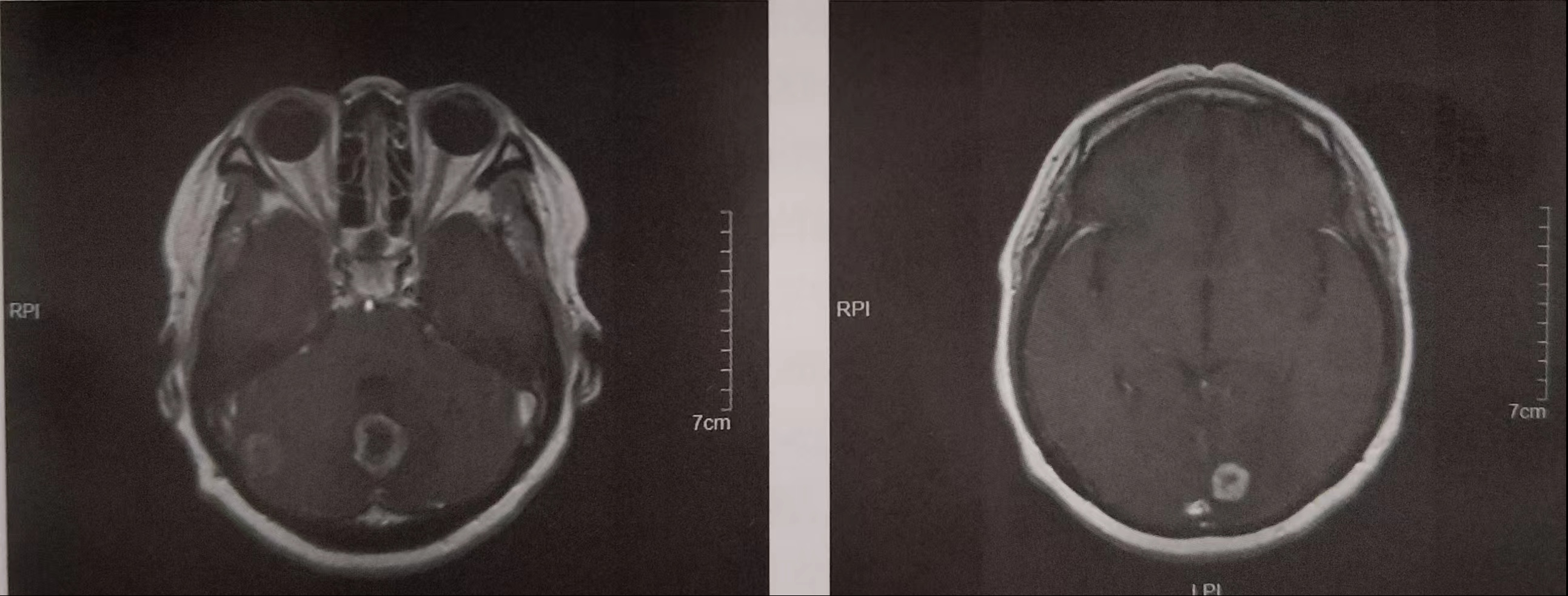
图2 2017-09-04颅脑MRI
第三次MDT讨论与治疗情况
讨论情况
影像科:颅脑MRI示小脑蚓部、右侧小脑半球及左侧枕叶各见一结节灶,T1WI上呈低信号,T2WI上呈稍高信号,增强后,强化较明显,厚壁环形强化;较大者位于小脑蚓部,直径约为2.2cmx2.0cm,边缘见小片状水肿影;结合肺癌病史及结节特征,首先考虑多发(约3枚)转移瘤,中线结构未见移位。
神经外科:患者颅内出现了3枚转移病灶,伴头晕的症状。此时患者的治疗应以全身治疗为主。但是,有别于其余部位的转移,脑转移,尤其是有症状的脑转移还是需要加用局部治疗。在单个NSCLC脑转移病灶的处理上,手术与SRS有着相当的效果。手术在单个转移病灶的直径>4cm时效果更优,而SRS更适合于多发转移的处理。该患者的脑部有3枚转移病灶,手术治疗不宜作为局部治疗的首选。
肿瘤内科:患者术后出现了有症状的脑多发转移,治疗上首选三代EGFR-TKI奥希替尼靶向治疗。在III期FLAURA试验中,将奥希替尼与一代靶向药(吉非替尼、厄洛替尼)作比较用于一线治疗EGFR Ex19缺失、Ex21敏感突变的患者。奥希替尼相比对照组的PFS分别为18.9个月和10.2个月,HR=0.46(95% CI:0.37~0.57),疾病进展或死亡风险降低54%,P<0.001,具有显著的临床价值。在脑转移亚组的疗效数据上,奥希替尼同样显示出非常卓越的疗效。在CNS全分析集中上,CNS mPFS分别为NR(未达到)vs13.9个月(HR=0.48;P=0.014);CNS ORR分别为66%vs43%(P=0.011)。基于以上的疗效数据,对于基线合并CNS转移的患者,奥希替尼是最佳的一线治疗选择。
放疗科:患者的原发病灶携带有EGFR敏感突变,本身携带敏感突变的患者相较于野生型EGFR患者容易出现脑转移。也有研究发现,相比于EGFR Ex21 L858R点突变的非小细胞肺癌患者,EGFR Ex19号外显子缺失的非小细胞肺癌患者更易出现颅内粟粒状转移病灶。相比于化疗,EGFR-TKI的副反应更轻、疗效更佳,由于一代EGFR-TKI厄洛替尼在脑脊液中的浓度仅为血浆中浓度的5%,三代EGFR-TKI相较于一代或二代EGFR-TKI,其脑脊液的浓度更高,对颅内病灶的控制也更好,但是FLAURA研究的亚组分析发现,在接受奥希替尼治疗过程中,也有高达18.9%的患者的颅内病灶出现进展。因此,对EGFR敏感突变的肺癌脑转移患者来说,对颅内病灶应进行早期放疗,而不是延迟放疗,更不是忽略放疗。对于这个患者,放疗技术的选择首选立体定向放疗,次选全脑放疗。
治疗情况
患者于2017-09-09起行全脑放疗:处方剂量CTV为全脑组织,均匀外放5mm后形成PTV,PTV处方剂量DT 30Gy/10F,以及脱水降颅压治疗。同时予易瑞沙250mg口服QD靶向治疗。治疗后患者的症状得到改善。当地医院复查脑MRI提示:脑转移瘤有所缩小。疗效评价:SD。
患者于2017-12-12因“双下肢麻木伴行动不能进行性加重1周”再次入院。入院查体:轮椅入院,神志清,精神可,双瞳孔等大等圆,对光反射存在,双侧下肢肌力1~2级,感觉减退。病理征阴性。PS=3。外院胸椎MRI示:脊髓内约T12椎体水平异常强化结节,PS=3结合病史考虑转移瘤。外院胸部CT示:两肺多发转移病灶。经外院脑脊液细胞学检查发现腺癌细胞。外院脑脊液NGS分子检测提示EGFREx19缺失突变,丰度0.04%,EML4-ALK融合基因阳性。对2016-12-08术后组织标本重新进行免疫组化(Ventana法),结果显示:EML4-ALK(+)。
目前诊断:右肺腺癌术后脑转移、脑膜转移、脊髓内转移、双肺转移,rT0N0M1b,IV期(AJCC第七版,2009)。
第四次MDT讨论与治疗情况
讨论情况
肿瘤内科:患者在易瑞沙治疗后很快出现了疾病进展,脑膜转移,脑脊液NGS检测发现患者有EGFR、ALK双突变。因为考虑到患者术后标本仅做过EGFR单基因检测,对术后标本重新进行免疫组化(Ventana法),结果显示:ALK(+)。因此,提示该患者有原发双突变。2008年,科伊夫门等在305例NSCLC中第1次发现1例双突变患者,同时伴有19外显子缺失和EML4-ALK重排。在NSCLC中双突变属于少见或罕见基因改变事件,发生率为0.3%~1.3%。双突变多见于女性、亚裔、不吸烟、IV期的肺腺癌患者。关于双突变患者的治疗都是一些小样本的回顾性研究,韩宝惠教授的一项回顾性研究中筛选了5816例患者,其中26例患者同时伴有EGFR突变和ALK重排,22例患者符合生存分析。另外,随机选取95例EGFR突变患者和60例ALK重排患者进行分析。EGFR/ALK共变患者EGFR-TKI的ORR为63.2%(12/19),中位PFS为10.3个月,克唑替尼的ORR分别为66.7%(8/12),中位PFS分别为11.1个月,OS为36.8个月,EGFR/ALK共变亚组的生存期较EGFR突变组更长,但无统计学差异(P=0.12)。结论:第一代EGFR-TKI和ALK-TKI crizotinib均有效。应将EGFR-TKI和ALK-TKI crizotinib的序贯治疗作为一种管理选择。考虑该患者在易瑞沙治疗后出现耐药,脑膜转移,建议更换为奥希替尼,同时联合克唑替尼或阿来替尼联合靶向治疗。考虑到当时的药物可及性,建议克唑替尼联合靶向治疗。
放疗科:脊髓内转移是非常罕见的恶性肿瘤转移。该患者甚至出现了局部神经受压的症状,建议在全身治疗的基础上对脊髓转移病灶进行姑息放疗,靶区包含脊髓转移病灶,定位时需要进行磁共振-CT图像融合,参照磁共振上的图像进行靶区勾画,PTV DT30Gy/10F。
治疗情况
患者自2017-12-20起予以吉非替尼250mg口服)+克唑替尼250mg口服BID靶向联合治疗,予以相应脊髓转移瘤姑息放疗,处方剂量DT30Gy/10F。服用靶向药物+放疗第5天,肌力恢复至4级,能在家属搀扶下行走,治疗第3个月能独立缓慢行走。患者出院后,在外院继续随诊。持续服用靶向药物。当地医院复查胸部CT
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。