最近被大家寄予厚望的“可乐组合”(帕博利珠单抗+仑伐替尼,LEAP-007研究)在肺癌中折戟沉沙,一石激起千层浪,尽管有以往I期研究的阳性结果作为铺垫,同时初期的疗效(PFS)还是有改善,但是最终还是因为OS没有获益而以失败而告终。
到底是什么原因导致了这种情况的出现呢,是“可乐组合”自身的疗效确实不行,还是以“可乐组合”为代表的PD-1+抗肿瘤血管小分子药物这种组合模式根本就在肺癌中不灵光呢?表面上看,是“可乐组合”的问题,但实际上这里面的水很深,弄清楚失败的原因不仅可以让以后的类似研究少踩坑,而且对这一组合的治疗人群来讲也能做到精准选择。
基于此,在下文中,我们将结合最新循证医学的证据从临床的角度对这一组合在肺癌中的应用进行剖析,希望能够对大家提供一定的帮助。
可乐组合的背景
“可乐组合”这一名称取自“可瑞达”与“乐卫玛”的首字,可瑞达与乐卫玛分别是帕博利珠单抗(一种PD-1/L1抑制剂)与仑伐替尼(一种抗VEGF小分子药物)两种药物的商品名[1],这一组合实际上也代表了PD-1+抗肿瘤血管小分子药物这种组合。
由于这两种药物单药的疗效已经在多个瘤种中得到了证实,而且这一组合模式也已经在晚期肾癌以及子宫内膜癌当中获批[2],所以这一组合在临床应用中还是积累了一些数据,考虑到这一组合本身就具备广谱的治疗属性,所以扩大应用范围也在情理之中,更何况是想要征服肺癌这一座“大山”。只可惜,在肺癌中多年的谋划还是功亏一篑,在让人们惋惜的同时也必然会引发思考。
可乐组合的疗效
目前LEAP-007研究的设计主要是将“可乐组合”对比帕博利珠单药应用于PD-L1阳性的驱动基因阴性的晚期非小细胞肺癌,在随访了15.9个月之后的结果显示,“可乐组合”能够改善晚期非小细胞肺癌的PFS(6.6m vs 4.2m)与ORR(40.5% vs 27.7%),但是最终的OS(14.1m vs 16.4m)并没有获益[1],而且亚组分析似乎也没有阳性结果发现,甚至发现鳞癌的患者获益更低,这也更增添了人们对“可乐组合”在肺癌中是否真的无效的怀疑。
可乐组合的毒副反应
目前该临床研究报道的“可乐组合”的常见毒副反应主要是高血压,蛋白尿,手足综合症等,其中3度以上的发生率接近60%,毒副反应的类型以及发生率也与以往的研究报道没有太大的差别。
对比于免疫治疗在肺癌中的其它研究,严重毒副反应确实有点高,而且增加的毒副反应在很大程度上就来自于仑伐替尼,更何况这一组合当中仑法替尼的剂量设定为20mg。尽管毒副反应跟疗效并没有太大的联系,但是严重的毒副反应也会导致患者对治疗的耐受性降低,从而影响治疗的顺利进行,并最终影响到OS的数据,这似乎也为OS不获益提供了一定合理的解释。
可乐组合失败的原因究竟何在?
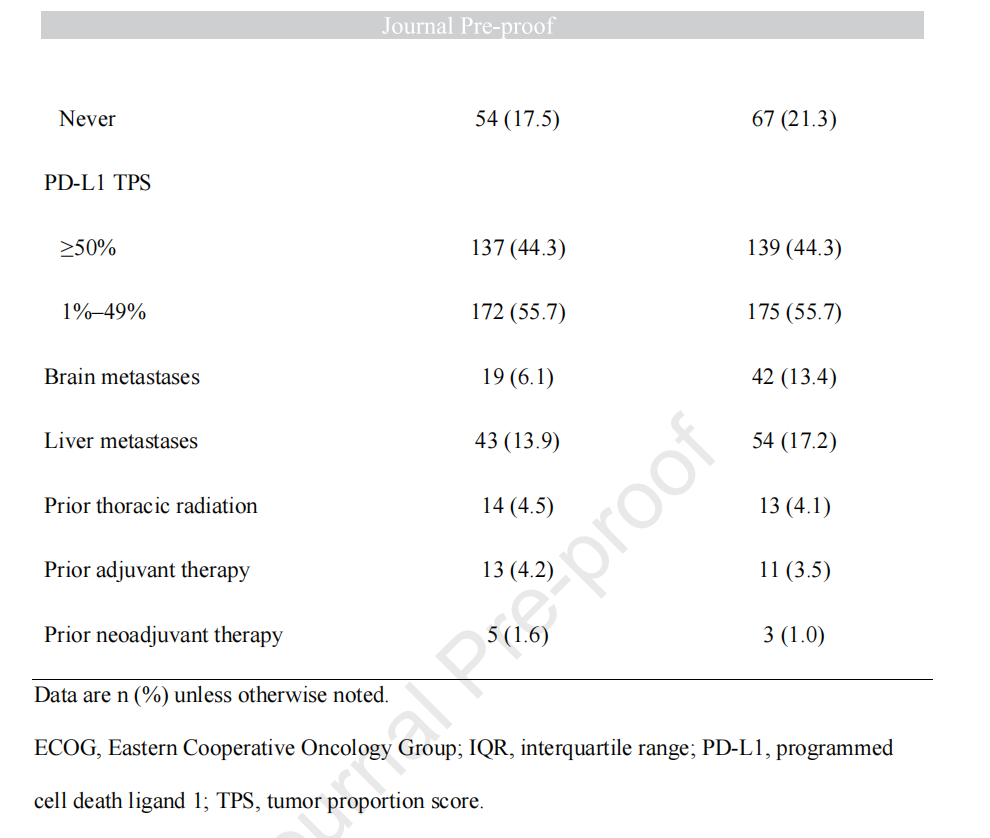
从整个研究的设计以及最终的结果来看,“可乐组合”在肺癌中之所以会失败有多方面的原因,首当其冲的就是入组人群选择的问题,尽管该研究表明上遵循了免疫治疗入组人群的一般套路,即体能评分状况好,吸烟的男性患者居多,肝脑转移患者的比例低(加在一起不超过20%)等,但是在入组人群上显然还没有进行进一步的细化,比如没有细分不同淋巴结转移患者的比例,比如N1,N2,N3的患者各占比多少,因为淋巴结好比是免疫系统的加油站,淋巴结转移越多的话免疫治疗的疗效也会越好。
除此以外,尽管PD-L1高表达患者的比例已经达到了44.3%,但是显然这一比例仍然不够高,尤其是对于“免疫治疗联合抗肿瘤血管小分子”而言,换言之,这一组合有可能并不适用于一般人群,而只能对PD-L1高表达(大于等于50%)的人群带来长期获益,其实这一结论已经在以往类似的研究中有所体现。
另外关于后续治疗模式的使用比例差异(14.2% vs 28%)以及“可乐组合”严重的毒副反应(57.9% vs 24.4%)也能从另外两个方面对研究最终的OS不获益进行解释,但实际上两者讲的是同一个问题,也就是毒副反应重导致治疗依从性差的问题。
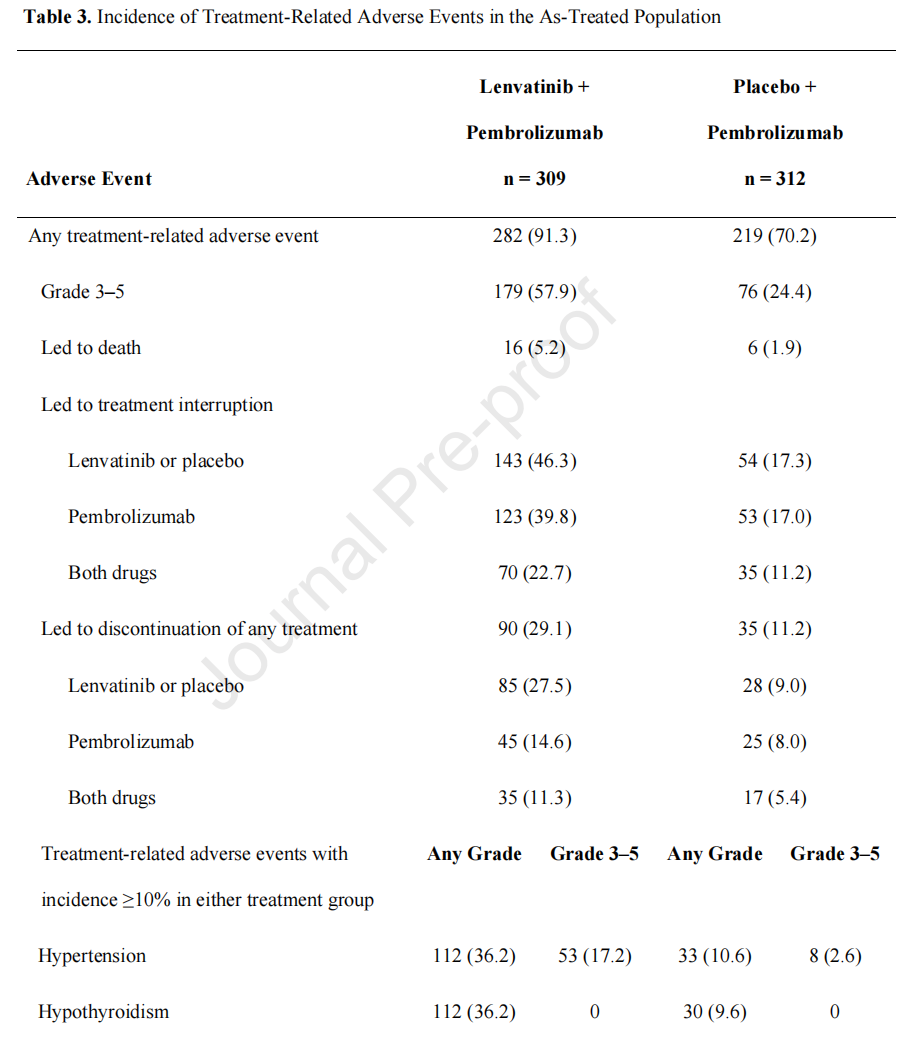
其实这一问题早在“可乐组合”应用于其它瘤种时已经出现了端倪,比如晚期肾癌的代表性临床研究CLEAR(仑伐替尼联合帕博利珠单抗或者依维莫司用于晚期肾癌治疗的一线研究)的3度以上毒副反应的比例就高达82%,而且该研究中仑伐替尼的初始剂量也为20mg[4]。
而实际上,“可乐组合”应用于子宫内膜癌的回顾性分析中[5],14mg的仑伐替尼很可能就已经足够,而且似乎剂量降低了,其疗效并没有受到影响。所以毒副反应重的问题其实就出在仑伐替尼的剂量上,如果将仑伐替尼的剂量降低的话,其毒副反应也会降低,而一旦耐受性提高的话,其OS也很可能会出现逆转的可能,这也为今后的探索提供了思路。
最后,尽管从事后分析的角度,也确实能够对研究的阴性结果给出看似合理的解释,但是不可否认的是以“可乐组合”为代表的这一组合其实在肺癌中还是有效的,而且我们也确实在临床研究中看到这一组合最起码是可以在短期内带来疗效改善(有效率提高12%,PFS改善2.4个月),即便是最终OS没有获益。
这其实也可以理解为对于一部分需要快速缓解症状或者无法耐受化疗的晚期肺癌患者而言,“可乐组合”还是具有一定应用的空间与价值的,只是需要我们对短期疗效有一个比较清晰的认识,同时也必须在临床中进一步优化剂量在确保疗效的同时尽可能的降低毒副反应。 换言之,临床对待这一模式,不能简单搞“一刀切”的模式,必须取其精华剔其糟粕。
结语
尽管“可乐组合”在肺癌中似乎没有达到最初的期望值,但是以“可乐组合”为代表的免疫治疗+抗肿瘤血管小分子药物“的治疗模式在临床治疗中的潜力与价值还是不应被忽视,因为确实在临床真实世界中,有为数不少的包括肺癌在内的晚期肿瘤患者从这一治疗模式中得到了生存获益。
成功了当然可喜可贺,但是失败了也许并非坏事,正因为”可乐组合'的失败,才会加深我们对这一组合在肺癌研究中的认识,才会让今后类似的研究少走弯路,才能为个体以及精准化的治疗提供更多可靠的证据。
参考文献:
1. Makker V, Rasco D, Vogelzang NJ, et al. Lenvatinib plus pembrolizumab in patients with advanced endometrial cancer: an interim analysis of a multicentre, open-label, single-arm, phase 2 trial. The Lancet Oncology. May 2019;20(5):711-718. doi:10.1016/s1470-2045(19)30020-8
2. Taylor MH, Lee CH, Makker V, et al. Phase IB/II Trial of Lenvatinib Plus Pembrolizumab in Patients With Advanced Renal Cell Carcinoma, Endometrial Cancer, and Other Selected Advanced Solid Tumors. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. Apr 10 2020;38(11):1154-1163. doi:10.1200/jco.19.01598
3. Makker V, Taylor MH, Aghajanian C, et al. Lenvatinib Plus Pembrolizumab in Patients With Advanced Endometrial Cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. Sep 10 2020;38(26):2981-2992. doi:10.1200/jco.19.02627
4. Chu T, Zhong R, Zhong H, et al. Phase 1b Study of Sintilimab Plus Anlotinib as First-line Therapy in Patients With Advanced NSCLC. Journal of thoracic oncology : official publication of the International Association for the Study of Lung Cancer. Apr 2021;16(4):643-652. doi:10.1016/j.jtho.2020.11.026
5. Motzer R, Alekseev B, Rha SY, et al. Lenvatinib plus Pembrolizumab or Everolimus for Advanced Renal Cell Carcinoma. The New England journal of medicine. Apr 8 2021;384(14):1289-1300. doi:10.1056/NEJMoa2035716
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。