基本病史
患者,女,1963年4月出生。2018年1月(55岁)因“头痛、头晕伴视物模糊半年”就诊。眼科检查发现:视盘水肿。头颅MR平扫示:脑室扩张。头颅MR A及SWI检查无异常。头晕、头痛、视物模糊进行性加重,伴恶心、呕吐、乏力、食欲缺乏,无发热、咳嗽、咳痰、晕厥、抽搐等不适。患者轮椅推入, ECOG评分3分, 精神萎靡, 格拉斯哥昏迷评分( GCS) 11分; 眼球活动正常, 瞳孔对光反射略迟钝,视力下降,视物模糊,视野无缺损;全身浅表淋巴结无肿大,双肺呼吸音清,腹软,无压痛、反跳痛,四肢肌力、肌张力正常;颈项强直、克尼格征和布鲁津斯基征阴性,病理征阴性。
入院后实验室及影像学检查
2018年2月血CEA 10867ug/L。腰椎穿刺脑脊液压力> 320mmH2O, CEA 550.1ug/L, 脑脊液中见大量肿瘤胞(腺癌),不除外乳腺、肺来源。胸部CT示:左上肺门处磨玻璃密度影(约3.3cm×1.6cm)(图1)。血和痰的细菌、真菌及病毒等检查未提示明显感染。因肿块位置近肺门大血管,支气管镜及肺穿刺活检困难,出血和大咯血风险极大, 家属不考虑活检。当时甘露醇250mlq6h+地塞米松2.5mgq6h降颅内压,患者颅内高压症状仍无明显缓解。因手术和放疗存在风险,家属不考虑行脑室-腹腔(VP)分流及放疗。再次腰椎穿刺行脑脊液基因检测:EGFR L858R突变(ARMS-PCR法) 。诊断:肺腺癌cT2N0M1(脑膜转移) Ⅳ期, EGFR L858R突变。
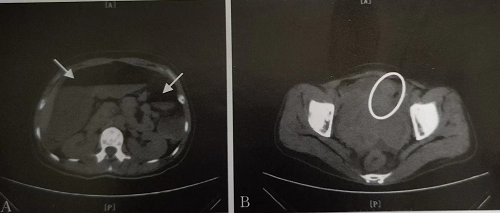
图1 胸部CT 左上肺门玻璃结节样病灶
入院后诊疗经过
2018年2月 开始口服埃克替尼(125mg,口服,tid)靶向治疗。2周后颅内高压症状迅速缓解,无需甘露醇降颅内压,血及脑脊液CEA逐渐下降, 肺内病灶稳定。
2019年1月头痛、头晕、视物模糊再次加重,再次腰椎穿刺,脑脊液中见大量腺癌细胞, 血及脑脊液CEA较2018年9月明显上升, 影像学检查提示肺内病灶稳定(见图1),全身无新发病灶。评估病情为进展。再次行脑脊液基因检测:EGFR T790M突变, L858R突变。
2019年2月开始三代靶向药物奥希替尼治疗(80mg,口服,qd)。治疗后约1个月头痛、头晕症状基本消失,视物模糊有所改善,疗效评价为PR。
2020年5月头痛、头晕、视物模糊明显加重, 影像学检查提示肺内病灶稳定、无新发病灶, CEA较前升高,考虑病情进展。2020年5月起用奥希替尼+贝伐珠单抗治疗至2023年3月。家属诉每3-5个月复查影像学,显示肺内病情稳定,偶有头痛、头晕、视物模糊,与2020年5月比较无加重,无新发不适。2023年9月病情进展患者死亡。
诊疗经过讨论
本病例初诊时为脑膜转移的NSCLC晚期, 患者实现了超过5年的长期生存。该患者虽未取得肿瘤组织标本,但整个诊疗过程的难点得到较好解决。
诊断
通过脑脊液细胞学检查而明确诊断,为难以获取组织标本且仅脑膜转移病例的诊断提供了范本。
患者影像学仅提示左上肺门病灶,近肺门支气管血管极丰富,呼吸科和胸外科均考虑支气管镜及肺穿刺活检难以获取组织标本,患者PS评分3分,家属亦不考虑以上操作。根据细胞学标本形态特点及免疫细胞化学染色结果可以对细胞学标本进行准确诊断、分型及判断细胞来源[1]。该该患者仅通过脑脊液细胞学标本形态学特点及免疫细胞化学染色结果明确诊断为肺腺癌脑膜转移。患者当时不适宜化疗,全脑全脊髓放疗及鞘内注射治疗的疗效有限,而且家属也不选择这些治疗,此时靶向治疗是患者及家的希望。因颅内高压症状极为明显,存在脑疝昏迷甚至死亡凤险,时间极其宝贵,如同与死神赛跑,此时该选用什么标本基因检测及选择何种基因检测方法,尤为重要。在难以获取肿瘤组织样本时可采用外周血循环肿瘤DNA(ct DNA) 作为补充标本来评估EGFR基因突变状态[2],而脑脊液上清液标本基因检测尚在探索中。但患者一般情况极差,血液基因检测等待时间较长,我科与检验科和病理科积极沟通后,决定使用细胞学制片以最短时间进行相关驱动基因检测(ARMS-PCR法) ,仅2天就得到基因检测报告,为EGFR L858R突变患者治疗带来曙光。因此,对于难以获取组织标本的仅脑膜转移的患者,可通过脑脊液细胞学标本进行细胞及分子病理诊断。
脑膜转移的疗效评价
本病例病程中因脑膜转移无可评估病灶,疗效评价缺乏统一标准,治疗过程中设置评价要素、治疗有效和进展的定义、疗效评价的时间点、变更治疗方案的关键节点等是临床医生面临的难点。我们主要参考RANO-LM神经影像学评价[3]及Pan Z症状、体征评价[4]确定主要疗效评价要素(神经症状评价、神经影像学评价及脑脊液细胞学进行疗效评价),同时结合ECOG评分、敏感的生化指标等相关评价要素米综合评估病情,丛而尽可能准确判断病情变化节点以便及时调整治疗方案。
治疗过程
“神经系统症状及体征、影像学检查和脑脊液检查”三驾马车贯穿诊疗始终。根据细胞分子病理、症状、体征、一般情况、生化指标及家属意愿等进行个体化治疗,在未进行放疗、化疗及鞘内注射基础上通过及时调整一系列靶向药物的治疗、使脑膜转移患者获得了长期生存。
患者存在EGFR L858R突变,CONVINCE研究提示埃克替尼较化疗明显延长患者PFS(11.2个月us 7.9个月) ,且3级及以上不良反应显著低于化疗。本病例中,一线治疗埃克替尼的PFS为11个月, 与文献报道基本相仿。靶向治疗期间及时发现埃克替尼治疗后的病情进展,并通过脑脊液基因再次检测,发现新出现T790M突变。AURA-3研究[6]显示接受一代TKI类药物治疗进展且携带T790M突变的局部晚期或转移性NSCLC患者, 144例中枢神经系统转移奥希替尼组、化疗组中位PFS(8.5个月v s 4.2个月),不良反应分别为23%和47%。本病例二线奥希替尼治疗的PFS为15个月, 在脑膜转移治疗进展后又取得了较长期的疾病控制。
研究提示[7],贝伐珠单抗可改善血管通透性,降低肿瘤血管密度,奥希替尼联合贝伐珠单抗可能在EGFR突变型NSCLC软脑膜转移模型中发挥协同作用。BRAIN研究[8]显示,贝伐珠单抗联合化疗或靶向治疗脑转移的非鳞型NSCLC患者疗效良好。奥希替尼和贝伐珠单抗的联合治疗可能对脑转移有效。一些研究评估了贝伐珠单抗联合奥希替尼与奥希替尼单药治疗后T790M突变的NSCLC患者疗效,结果中位PFS无明显差异, 但联合组中枢神经系统效率更高。在本病例中,我们将贝伐珠单抗联合奥希替尼作为三线治疗, PFS>34个月, 获得了对脑膜转移的极好长期控制,无明显重叠毒性作用。贝伐珠单抗联合奥希替尼对奧希替尼治疗后脑膜转移患者的益处仍存在不确定性,还需进一步的研究来探索哪些特征可以预测患者能从联合治疗中获益。
综合来看, 本病例充分展示了EGFR突变肺腺癌的临床特点和治疗策略。对于EGFR突变的患者,靶向治疗是非常重要的治疗策略,可以显著改善预后。然而,治疗的持久性仍然受到继发耐药的限制,其中继发的T790M突变是最重要的分子特征。在此背景下,及时进行基因检测,调整治疗方案,可以为患者提供更好的治疗效果和生存质量。对脑膜转移的患者,进行脑脊液的检测可以提供重要信息。脑脊液细胞学检查可以确定脑膜转移的病理学类型,脑脊液的基因检测也可以提供分子特征信息, 如EGFR突变、ALK融合等, 在进行脑脊液基因检测时, 常用的方法包括PCR、ARMS-PCR、NGS等。这些方法可以快速准确地检测出肿瘤细胞中的特定基因突变,为治疗方案的制订提供指导。
参考文献
1.中国临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO) 非小 细胞肺癌诊疗指南2022[M].北京:人民卫生出版社,2022.
2.GOT OK, ICHINOSE Y, O HEY, etal.Epidermalgrowthfactor receptorr mutationstatussin circulatingfree DNAinseru i:trom IPASS, a phaseIllstudy ofgefitinib or carboplatin/pa chtaxel111 small cell lung cancer[J] .J Thorac Oncol, 2012, 7(1) :115-121.
3.CHAMBERLAIN M, JUN CKL, BRANDS MAD, et alLLepto men in geali metastases:aaRAN Opproposalfor response criteria[J].Neuro Oncol, 2017, 19(4) :484-492.
4.PAN Z, YANG G, HEH,etal.Concurrentradiotherapyyand intra the caalmethotrexate for treating lepto men ingemetastasisi roms dtmoswi advrse prgnstfcors:apr pctv e and searm study[J] .IntJ Cancer, 2016, 139(8) :1864-1872.
5.SHI YK, WANG L.HAN BH.otal st in cici leusateeexedpuspemetexedma tenance the apy for panswadancdEGFRmutinpoteung adeno car anoma(CONVICE:a pase 3, open label rando ied study[J] .Ann Oncol, 2017, 28(10):2443-2450.
6.MO KTS, WU YL, AHNM」, etal.Osi etb or paunpemeexediEGFRT790M-pos ive lung cancer[J] .NEng lJ Med,2017,376:629-640.
7. YI Y, CA IJ, X UP, etal Potent il benefit of osi mert iib plusbevacizumab in leptomeningeal metastasis with EGFR mutant non-small-cell lung cancer[J] .J Transl Med, 2022, 20(1) :122. 8.BESSE B, LE MOULE CS, MAZIE RES J, etal.Be vac zuma binpatients with non squamous non-small cell lung cancer and asymptomatic,untreated brain metastases(BRAIN) :a nonrandomized, phaseⅡstudy[J] .Clin Cancer Res, 2015, 21(8) :1896-903.
9.AKAMATSU H, TO IY, HAYASHI H,etal.Efficacy ofosi mert in ib plus bevacizumab vsosimertinibin patients with EGFRT790M-mutt d non-smal cell ung cancer previusytreaedwihepidermalgrowthfactorreceptor-tyrosinekinaseinhibitor:WestJapanOncology Group 8715L phase 2 randomized linical trial[J] .JAMAOncol, 2021, 7(3) :386-394. 08.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。